
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз солей, образованных слабыми кислотами и сильными основаниями
|
|
ГИДРОЛИЗ СОЛЕЙ
Методические указания к лабораторной работе
Великий Новгород
Гидролиз солей/Составители: В.П. Кузьмичёва, В.А. Исаков – НовГУ, Великий Новгород, 2013 г. – 16 с.
Методические указания предназначены для студентов всех специальностей, изучающих химию.
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ | ||
| ЦЕЛЬ РАБОТЫ | ||
| ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ | ||
| 2.1 Гидролиз солей, образованных слабыми кислотами и сильными основаниями | ||
| 2.2 Гидролиз солей, образованных слабыми основаниями и сильными кислотами | ||
| 2.3 Гидролиз солей образованных слабыми кислотами и слабыми основаниями 2.4 Гидролиз кислых солей и оценка среды их водных растворов | ||
| 2.5 Способы усиления и подавления гидролиза 2.6 Реакции взаимного усиления гидролиза | ||
| ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ | ||
| ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ | ||
| 4.1 Соли, образованные сильными основаниями и сильными кислотами | ||
| 4.2 Соли, образованные слабыми кислотами и сильными основаниями 4.3 Соли, образованные слабыми основаниями и сильными кислотами 4.4 Смешение ионного равновесия обратимого гидролиза 4.5 Химическое растворение металлов в водных растворах гидролизующихся солей 4.6 Взаимодействие растворов солей, взаимно усиливающих гидролиз друг друга | ||
| ТРЕБОВАНИЯ К СОДЕРЖАНИЮ И ОФОРМЛЕНИЮ ОТЧЕТА | ||
| ВОПРОСЫ И ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ | ||
| ЛИТЕРАТУРА |
ВВЕДЕНИЕ
Гидролиз является разновидностью ионных реакций и представляет собой обменное взаимодействие некоторых солей с водой.
Реакция гидролиза имеет место лишь в тех случаях, когда ионы, образующиеся при диссоциации соли, способны образовывать с ионами - продуктами ионизации воды (Н+, ОН-) нерастворимые, газообразные или малодиссоциированые соединения (молекулы или сложные ионы).
Гидролизу подвергаются соли трёх видов. Это соли образованные:
1) слабой кислотой и сильным основанием;
2) слабым основанием и сильной кислотой;
3) слабой кислотой и слабым основанием.
В обычных условиях гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой.
ЦЕЛЬ РАБОТЫ
Цель работы – изучение некоторых свойств водных растворов солей, связанных с реакцией гидролиза.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Гидролиз солей, образованных слабыми кислотами и сильными основаниями
Гидролиз солей слабых одноосновных кислот
Рассмотрим первый случай гидролиза на примере ацетата натрия (соли слабой уксусной кислоты и сильного основания гидроксида натрия):
CH3COONa + H2O ↔ СН3СООН +NaOH
или в молекулярно-ионной форме:
Na+ + CH3COO- + H2O ↔ CH3COOH + Na+ + ОН-
Катионы Na+ с ионами Н+ и ОН- не образуют малодиссоциированных соединений, поэтому они не принимают участия в этой реакции. Исключив катионы натрия получим сокращенное молекулярно-ионное уравнение реакции гидролиза ацетата натрия:
СНзСОО- + Н2О ↔ СНзСООН + ОН-.
щелочная среда
рН > 7
Для количественной оценки реакции гидролиза используют константу гидролиза Кh, степень гидролиза h и значения рН растворов солей.
В основе вывода формулы константы гидролиза лежит сокращенное молекулярно-ионное уравнение реакции гидролиза.
Константа равновесия этой реакции имеет вид:
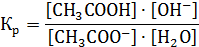
Далее это выражение преобразуем:
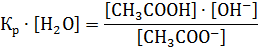
Величину Кр · [H2O] принимают за константу гидролиза Кh, т.е.
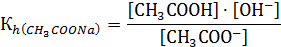
Величину [OH-] можно определить 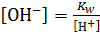 , тогда
, тогда
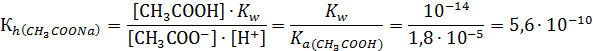
Таким образом, Kh обратно пропорциональна Ka слабой кислоты, т.е. чем слабее кислота, соответствующая данной соли, тем больше константа гидролиза.
Степень гидролиза (h) это отношение числа ионов, подвергшихся гидролизу (Nгидр.), к исходному числу введенных в раствор ионов этого вида (No):
h = Nгидр./No
Степень гидролиза h рассчитывается по уравнению:
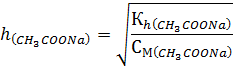
Так как [OH-] = h · CM, то 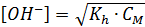
Отсюда рОН = - lg [OH-] и рН = 14 – рОН
Гидролиз солей слабых многоосновных кислот
Гидролиз таких солей – процесс многоступенчатый, протекает через последовательный ряд стадий. Например, при гидролизе Na2S, первая ступень имеет вид:
Na2S + H2O ↔ NaHS + NaOH
2Na+ + S2- + H2O ↔ Na+ + HS- + Na+ + OH-
S2- + H2O ↔ HS- + OH-
Количественно гидролиз по первой ступени можно охарактеризовать константой гидролиза:
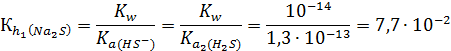
Затем в реакцию обменного взаимодействия с водой вступает гидросульфид-ион:
NaHS + H2O ↔ H2S + NaOH
Na+ + HS- + H2O ↔ H2S + Na+ + OH-
HS- + H2O ↔ H2S + OH-
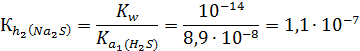
Следует обратить внимание, что количественно вторая ступень гидролиза протекает в несравнимо меньшей степени, чем первая. Поэтому в ответе достаточно указать уравнение только для первой ступени, например:
Na3PO4 + H2O ↔ Na2HPО4 + NaOH
РО43- + Н2О ↔ НРО42- + ОН-