
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз кислых солей и оценка среды их водных растворов
|
|
Кислые соли слабых многоосновных кислот тоже подвергаются гидролизу. Так, в водном растворе NaHCO3 устанавливается равновесие:
HCO3- + H2O ↔ H2CO3 + OH-,
константа которого
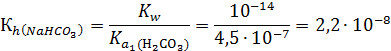
Константа гидролиза NaHCO3 количественно характеризует тенденцию иона HCO3- присоединять ионы Н+ из воды, освобождая эквивалентное число ионов OH-.
Однако, ион HCO3- участвует и в процессе электролитической диссоциации:
HCO3- ↔ H+ + CO32-,
константа которого 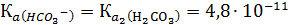 количественно характеризует противоположную тенденцию гидроаниона – отщеплять протоны.
количественно характеризует противоположную тенденцию гидроаниона – отщеплять протоны.
Для раствора NaHCO3 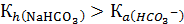
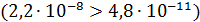 и, следовательно, преобладает тенденция ионов HCO3- присоединять протоны из воды, что согласуется с опытом, показывающим, что раствор NaHCO3 имеет слабо щелочную реакцию среды.
и, следовательно, преобладает тенденция ионов HCO3- присоединять протоны из воды, что согласуется с опытом, показывающим, что раствор NaHCO3 имеет слабо щелочную реакцию среды.
В случае дигидрофосфата натрия NaH2PO4 реакцию среды определяют следующие конкурирующие равновесия:
1) H2PO4- + Н2О ↔ Н3РО4 + ОН- (гидролиз)
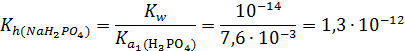
2) H2PO4- ↔ НРО42- + Н+ (диссоциация)
Константа диссоциации иона H2PO4- - это вторая константа диссоциации фосфорной кислоты 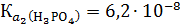
Реакция среды будет определяться тем равновесием, которое характеризуется большим значением константы:
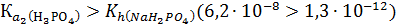
Следовательно, реакция среды в водном растворе NaH2PO4 кислая, рН < 7.