
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ионное произведение воды
|
|
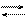 H2O H+ + OH-
H2O H+ + OH-
Вода является слабым электролитом.
Слабый электролит характеризует константа электролитической диссоциации
KДИС (H2O) = 1, 8× 10-16
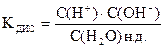
Физико-химическими методами установлено, что при t°=25°C концентрация диссоциированных молекул равна:
СД (H2O) = 10-7 моль/л
Общую концентрацию воды можно вычислить:
М (H2O) = 18, 015 г/моль
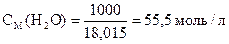
где 1000 - масса одного литра воды.
СН.Д. (H2O) = 55, 5 - 10-7» 55, 5 моль/л
Все известные величины подставляем в константу электролитической диссоциации

Отсюда
С(H+) × C(OH-) = 1, 8 × 10-16 × 55, 5 = 10-14
Величину произведения С(H+)× C(OH-) называют ионным произведением воды и обозначают K(H2O).
K(H2O) = С(H+) × C(OH-)
K(H2O) = 10-14
С(H+) × C(OH-) = 10-14
Выводы
1) Произведение концентраций ионов H+ и OH- имеет постоянное значение 10-14 при t°=25°C. Поэтому если увеличить в несколько раз концентрацию ионов H+, концентрация ионов OH- уменьшится во столько же раз. И наоборот.
2) В водном растворе любого электролита всегда содержатся H+ и OH-, а произведение их концентраций равно 10-14 при t=25°C.
Концентрация H+ или OH- не может быть равна " 0" в водном растворе.
Концентрированный раствор кислоты содержит H+ и OH-, но концентрация H+ значительно больше концентрации OH-.
Концентрированный раствор щелочи содержит OH- и H+, но концентрация OH- значительно больше концентрации H+.