
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вывод формулы для вычисления рН в растворах слабых оснований
|
|
 МОН М+ + ОН-
МОН М+ + ОН-
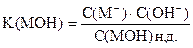
Из уравнения диссоциации
С(ОН-) = С(М+)
С(МОН) н.д.» С(МОН)
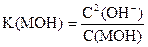
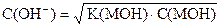

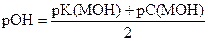
 |
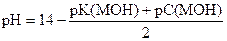
Примеры расчета
1. Вычислить концентрацию ОН- ионов и рН в 0, 1н растворе NH3× H2O.
| Дано: С (NH3× H2O) = 0, 1 моль/л K (NH3× H2O) = 1, 76× 10-5 |
| С(ОН-) =? рН =? |
Решение:
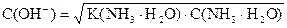
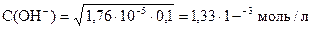
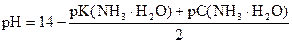
pK(NH3× H2O) = - lg 1, 76× 10-5 = (- lg 1, 76) + (- lg 10-5) = 5 - 0, 25 = 4, 75
pC(NH3× H2O) = - lg 0, 1 = - lg 10-1 = 1
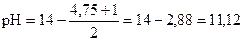
среда щелочная
2. рН = 11, 2. Вычислить нормальную концентрацию NH3× H2O.
| Дано: рН = 11, 2 С (HCOOH) = 0, 02 моль/л K (NH3× H2O) = 1, 76× 10-5 |
| Сн (NH3× H2O) =? |
Решение:
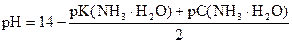
pK(NH3× H2O) = - lg 1, 76× 10-5 = (- lg 1, 76) + (- lg 10-5) = 5 - 0, 25 = 4, 75
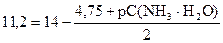
22, 4 = 28 - 4, 75 - pС(NH3× H2O)
22, 4 - 28 + 4, 75 = - pС(NH3× H2O)
- 0, 85 = - pС(NH3× H2O)
pС(NH3× H2O) = 0, 85
- lg С(NH3× H2O) = 0, 85
lg С(NH3× H2O) = - 0, 85
lg С(NH3× H2O) = lg 10-0, 85
С(NH3× H2O) = 10-0, 85
С(NH3× H2O) = 10+0, 15 × 10-1
С(NH3× H2O) = 1, 4 × 10-1 = 0, 14 моль/л