
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Краткие теоретические сведения и основные формулы. Учебная цель: добиться понимания физической сущности законов распределения молекул идеального газа, находящегося в равновесном состоянии
|
|
РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО ЭНЕРГИЯМ
Учебная цель: добиться понимания физической сущности законов распределения молекул идеального газа, находящегося в равновесном состоянии, по кинетической и потенциальной энергиям. Привить навыки самостоятельного решения задач на данную тему.
Литература
Основная: Детлаф А.А., Яворский Б.М. Курс физики. - М.: Высшая школа, 1989. - Гл. 10, § 10.3 - 10.5.
Дополнительная: Савельев И.В. Курс физики. - М.: Наука, 1987. - Т.1. - гл. 11, § 94 - 101.
Контрольные вопросы для подготовки к занятию
1. В чем состоит статистический метод исследования в молекулярной физике?
2. Каков физический смысл функции распределения молекул по скоростям?
3. Начертите график функции распределения молекул по скоростям и дайте его анализ:
а) Почему график функции начинается с нуля, достигает максимума, а затем асимптотически стремится к нулю?
б) Каков физический смысл элементарной площади 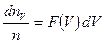 и всей площади под графиком?
и всей площади под графиком?
в) Сравните график функции распределения при различных температурах для одного и того же газа (m = const) и при одинаковой температуре для разных газов.
4. Дайте определение средней квадратичной, средней арифметической и наиболее вероятной скоростей молекул. Какими формулами они выражаются?
5. Запишите выражение закона распределения Больцмана. Что этот закон учитывает?
6. Запишите выражение зависимости атмосферного давления от высоты (барометрическая формула), поясните физический смысл величин, входящих в это выражение.
7. Начертите график зависимости давления от высоты для разных газов при данной температуре и для одного и того же газа при разных температурах.
8. В чем отличие распределений Максвелла и Больцмана?
Краткие теоретические сведения и основные формулы
Задача о распределении молекул идеального газа по скоростям поступательного движения была поставлена и решена Д. К. Максвеллом. Он установил закон, позволяющий определить, какое число молекул 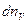 из общего количества n молекул идеального газа в единице объема обладает при данной температуре скоростями, лежащими в интервале от V до V + dV.
из общего количества n молекул идеального газа в единице объема обладает при данной температуре скоростями, лежащими в интервале от V до V + dV.
Закон распределения молекул по скоростям (закон Максвелла) имеет следующий вид:
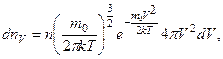 (20.1)
(20.1)
где 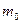 – масса молекулы, k – постоянная Больцмана, Т – абсолютная температура.
– масса молекулы, k – постоянная Больцмана, Т – абсолютная температура.
Из формулы (20.1) можно определить наиболее вероятную скорость Vвер, соответствующую максимуму выражения 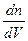 :
:
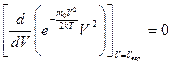 .
.
Решение этого уравнения имеет вид
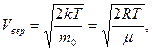
где m - молярная масса газа, R – универсальная газовая постоянная.
Графически закон Максвелла представляется кривой линией (рис.20.1), исходящей из начала координат, достигающей максимума при V = Vвер и затем асимптотически приближающейся к оси абсцисс.
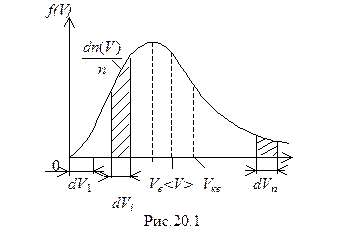 |
Относительное число молекул 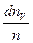 , скорости которых лежат в интервале от V до V + dV, находится как площадь заштрихованного на рис. 20.1 элементарного прямоугольника. Следовательно, площадь, заключенная между всей кривой распределения и осью абсцисс
, скорости которых лежат в интервале от V до V + dV, находится как площадь заштрихованного на рис. 20.1 элементарного прямоугольника. Следовательно, площадь, заключенная между всей кривой распределения и осью абсцисс 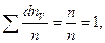 т.е. при любой температуре остается постоянной и выражает вероятность нахождения частиц со скоростями от нуля до бесконечности.
т.е. при любой температуре остается постоянной и выражает вероятность нахождения частиц со скоростями от нуля до бесконечности.
Наряду со средней квадратичной и наиболее вероятной скоростями для молекул газа характерна средняя арифметическая скорость, которую также можно определить из закона Максвелла:
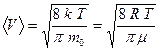 .
.
При повышении температуры газа увеличиваются скорости Vвер, < V>, Vкв, а следовательно, максимум кривой смещается вправо. Однако площадь, ограниченная кривой, должна оставаться неизменной. В связи с этим при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться (рис.20.2). А это означает, что доля молекул, обладающих большими скоростями, увеличивается за счет доли молекул, обладающих малыми скоростями.
Существование распределения молекул по скоростям, а следовательно, и по кинетическим энергиям теплового движения подтверждено различными опытами, например опытами Штерна.
При выводе основного уравнения молекулярно-кинетической теории газов предполагалось, что на молекулы газа не действуют никакие внешние силы. Поэтому можно было считать, что молекулы равномерно распределены по объему сосуда. Фактически молекулы любого газа всегда находятся в поле тяготения Земли. Тяготение и тепловое движение приводят газ в состояние, при котором его концентрация и давление убывают с высотой.
Закон распределения молекул в зависимости от их потенциальной энергии в любом силовом поле (закон распределения Больцмана) имеет вид
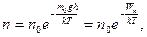 (20.2)
(20.2)
где Wn – потенциальная энергия молекулы в поле тяготения; 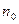 – концентрация молекул на высоте h = 0.
– концентрация молекул на высоте h = 0.
Формула (20.2) распределения Больцмана позволяет получить выражение зависимости атмосферного давления от высоты:
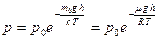 . (20.3)
. (20.3)
Выражение (20.3) называют барометрической формулой. Из барометрической формулы следует, что давление газа убывает с высотой по экспоненциальному закону.
Распределение Максвелла можно представить в виде
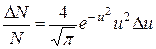 ,
,
где 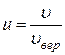 - относительная скорость, u - данная скорость;
- относительная скорость, u - данная скорость; 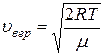 - наиболее вероятная скорость молекул; Du – величина интервала относительных скоростей, малая по сравнению со скоростью u.
- наиболее вероятная скорость молекул; Du – величина интервала относительных скоростей, малая по сравнению со скоростью u. 
Таблица 1.
| u | 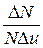
| u | 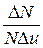
| u | 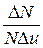
| u | 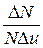
|
| 0, 7 | 0, 68 | 1, 4 | 0, 63 | 2, 1 | 0, 12 | ||
| 0, 1 | 0, 02 | 0, 8 | 0, 76 | 1, 5 | 0, 54 | 2, 2 | 0, 09 |
| 0, 2 | 0, 09 | 0, 9 | 0, 81 | 1, 6 | 0, 46 | 2, 3 | 0, 06 |
| 0, 3 | 0, 18 | 0, 83 | 1, 7 | 0, 36 | 2, 4 | 0, 04 | |
| 0, 4 | 0, 31 | 1, 1 | 0, 82 | 1, 8 | 0, 29 | 2, 5 | 0, 03 |
| 0, 5 | 0, 44 | 1, 2 | 0, 78 | 1, 9 | 0, 22 | ||
| 0, 6 | 0, 57 | 1, 3 | 0, 71 | 0, 16 |
Для нахождения числа молекул Nx скорости которых превышают заданное значение скорости u, пользуются таблицей 2, где даны значения 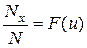 , где N – общее число молекул.
, где N – общее число молекул.
| u | 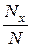
| u | 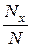
| u | 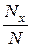
|
| 0, 6 | 0, 868 | 1, 25 | 0, 374 | ||
| 0, 2 | 0, 994 | 0, 7 | 0, 806 | 1, 5 | 0, 213 |
| 0, 4 | 0, 957 | 0, 8 | 0, 734 | 0, 046 | |
| 0, 5 | 0, 918 | 0, 572 | 2, 5 | 0, 057 |