
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Термический КПД идеального цикла Карно
|
|
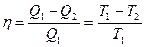 , (22.7)
, (22.7)
где 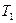 – абсолютная температура нагревателя,
– абсолютная температура нагревателя, 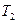 – абсолютная температура холодильника.
– абсолютная температура холодильника.
Цикл Карно, проведенный в обратном направлении, является идеальной холодильной установкой с холодильным коэффициентом:
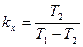 . (22.8)
. (22.8)
Первое начало термодинамики, являясь выражением закона сохранения и превращения энергии, не позволяет, однако, определить направление протекания процессов в природе. Периодически действующий двигатель, который совершал бы работу в количестве, равном подведенному ему теплу (вечный двигатель второго рода), не противоречит первому закону. Но он запрещается вторым законом термодинамики.
Сущность второго закона термодинамики выражается несколькими формулировками:
1. Для перевода тепла в работу необходимо наличие, кроме источника тепла, охладителя более низкой температуры (С. Карно (1796 - 1832) – фр. физик, инженер).
2. Тепло само по себе не может перейти от более холодного тела к более теплому (Р. Клаузиус (1822 - 1888) – нем. физик).
3. Невозможен круговой процесс, единственным результатом которого была бы механическая работа, совершенная за счет охлаждения теплового резервуара (В. Томсон (1824 - 1907) – англ. физик).
4. Невозможен такой периодический процесс, единственным результатом которого было бы превращение теплоты в работу (М. Планк (1858 - 1947) – нем. физик).
На основании выражений (22.7) можно записать:
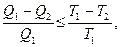 (22.9)
(22.9)
где знак ² = ² относится к обратимому процессу, а знак ² < ² - к необратимому. Учитывая, что 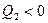 , выражение (22.9) примет вид
, выражение (22.9) примет вид
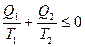 . (22.10)
. (22.10)
Отношение количества теплоты, получаемого или отданного рабочим телом, к температуре, при которой происходит теплообмен, называется приведенным количеством теплоты. Выражение (22.10) можно сформулировать так: алгебраическая сумма приведенных количеств теплоты за цикл не больше нуля (в обратимом цикле равна нулю, в необратимом – меньше нуля).
Сумму приведенных количеств теплот для обратимого процесса можно представить как разность значений некоторой функции состояния, которую называют энтропией:
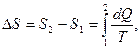 (22.11)
(22.11)
где 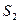 и
и 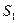 – энтропия в конечном 2 и начальном 1 состояниях соответственно;
– энтропия в конечном 2 и начальном 1 состояниях соответственно; 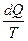 является дифференциалом энтропии:
является дифференциалом энтропии:
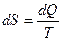 . (22.12)
. (22.12)
Если dQ > 0, то dS > 0; если dQ < 0, то dS < 0. Следовательно, возрастание или убывание энтропии указывает на направление теплообмена.
С учетом первого закона термодинамики 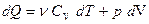 уравнение (22.11) примет вид
уравнение (22.11) примет вид
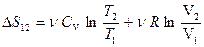 .
.
При переходе термодинамической системы из состояния 1 в состояние 2 изменение энтропии не зависит от вида процесса, определяется только начальными и конечными параметрами состояния (значениями температуры и объема в этих состояниях).
Второе начало термодинамики является статистическим законом: оно отражает закономерности движения огромного числа частиц тел, входящих в состав изолированной системы.