
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Побудова кривих методу протолітометрії.
|
|
Отже, як вже було показано, точка еквівалентності може знаходитися в нейтральній, кислій або лужній областях в залежності від природи реагуючих кислоти і основи. Часто необхідно знати, як зміниться рН в процесі титрування, поблизу т.е., яке значення рН має розчин в т.е. Щоб відповісти на ці всі питання роблять розрахунок і побудову кривих титрування. Криві титрування в методі кислотно-основного титрування – це графічне зображення зміни рН розчину при поступовому додаванні робочого розчину до визначеної кількості досліджуваного розчину. Для спрощення розрахунків (що не приводить до помітних похибок) звичайно не враховують розведення розчину в процесі його титрування, а також користуються поняттями „концентрація”, а не „активність”.
Метод побудови кривих титрування. Припустимо, наприклад, що 100мл 0, 1н розчину HCl титрують 0, 1н розчином NaOH.
Розраховуємо рН в різні моменти титрування.
А) До початку титрування є 0, 1н тозчин HCl. [HCl] = CHCl = [H+].
Тоді рН = - lg0, 1 = 1, 0
Б) До т.е.
Припустимо, що до100 мл 0, 1н HCl додамо 90 мл 0, 1н розчину NaOH. При цьому 90% (тобто 0, 9) від усієї кількості HCl буде нейтралізовано. Вільної кислоти залишиться в 10 разів менше, ніж її було до початку титрування. А так як змінами об’єму нехтують, то можна вважати, що концентрація вільної кислоти (Скисл) в 10 разів менша, ніж була спочатку, тобто стала рівна 0, 01моль/л. Відповідно, рН розчину в цей момент буде приблизно рівний 2.
Коли до титрованого розчину додають 99 мл 0, 1 н NaOH, то концентрація вільної HCl стане 0, 001н, а рН = 3.
При додаванні 99, 9мл 0, 1н NaOH, концентрація кислоти буде 0, 0001, а рН = 4, 0.
В) В т.е., тобто коли до 100мл 0, 1н HCl додали рівно 100 мл 0, 1н NaOH розчин буде містити лише NaCl.
Оскільки, NaCl не піддається гідролізу, рН розчину буде рівне 7.0. Саме в цей момент слід закінчувати титрування.
Г) Після т.е. Для того, щоб отримати уявлення про хід зміни рН в тих випадках, коли титрують луг кислотою, продовжимо розрахунок аж до 100% надлишкуNaOH. Припустимо, що додано лугу на 0, 1мл більше, ніж потрібно, тобто 100, 1мл. Оскільки концентрація NaOH така ж, як в HCl, то надлишкова кількість (0, 1мл) лугу повинна створити таку ж концентрацію OH- в розчині, яку концентрацію Н+ іонів створював надлишок HCl, рівний 0, 1 мл.
Відповідно,
[H+]=10-10, a pH=10.
Коли надлишок лугу становить 1мл, то
;
[Н+]=10-11, рН=11.0.
коли додано лугу 10мл надлишку, то
,
[Н+]=10-12, рН=12.0.
Коли додано лугу на 100мл більше, то
;
[Н+]=10-13, рН=13.0.
Отримані результати наведені в таблиці.
Зміна рН при титруванні 100мл 0, 1н розчину HCl 0, 1н розчином NaOH (або навпаки)
| ДоданоNaOH, мл | С кислоти, моль/л | С лугу, моль/л | [H+] | [OH-] | pH |
| 0, 1 | - | 10-1 | 10-13 | 1.0 | |
| 0, 01 | - | 10-2 | 10-12 | 2.0 | |
| 0, 001 | - | 10-3 | 10-11 | 3.0 | |
| 99.9 | 0, 0001 | - | 10-4 | 10-10 | 4.0 |
| 100.0(т.е) | - | - | 10-7 | 10-7 | 7.0 |
| 100.1 | - | 0, 0001 | 10-10 | 10-4 | 10.0 |
| 101.0 | - | 0, 001 | 10-11 | 10-3 | 11.0 |
| 110.0 | - | 0, 01 | 10-12 | 10-2 | 12.0 |
| - | 0, 1 | 10-13 | 10-1 | 13.0 |
При побудові кривих титрування на осі абсцис відкладають об’єм доданого титранту (титранту або лугу), а на осі ординат відповідну йому величену рН.
 Хід кривої зліва характеризує зміну рН при титруванні кислоти лугом. І, навпаки, справа ліворуч – відповідає зміні рН при титруванні лугу кислотою.
Хід кривої зліва характеризує зміну рН при титруванні кислоти лугом. І, навпаки, справа ліворуч – відповідає зміні рН при титруванні лугу кислотою.
Розглядаючи криву титрування 0, 1н розчину хлоридної кислоти 0, 1н розчином їдкого натру, перш за все зауважуємо, що т.е. збігається (співпадає) в т. нейтралізації (рН=7.0). далі увага зосереджується на тому, що поблизу кінця титрування спостерігається різкий стрибок рН. Справді, при додаванні лугу 99, 9мл рН розчину змінюється всього на 3 одиниці (від 1 до 4), перехід від 0, 1мл HCl надлишку доданого NaOH дає зміну рН на цілих 6 одиниць.
Зрозуміло, що наявність стрибка рН в кінці титрування дуже вигідна.
Дійсно, з основного рівняння теорії індикаторів:
випливає, що різкій зміні рН розчину від останніх 1-2 крапель лугу повинна відповідати різка зміна співвідношення Скисл.ф/Служн.ф, а відповідно і різка зміна забарвлення індикатора. Якщо б стрибок рН на кривій титрування був відсутній, то забарвлення розчину змінювалося б повільно і поступово і було б невідомо, в який момент потрібно закінчити титрування. А значить точне титрування було б неможливе.
Які ж висновки можна зробити із кривої титрування щодо вибору індикатора. На перший погляд може здатися, що повинен бути використаний індикатор, забарвлення якого змінюється при рН 7.0, тобто якраз в т.е. даного титрування, наприклад лакмус чи бромтимоловий синій, показник титрування яких біля 7.
Однак, якщо врахувати стрибок титрування, то стає зрозумілим, що можна застосовувати і метиловий оранжевий, хоча з ним титрування закінчується не при рН 7, а при рН 4, або фенолфталеїн, так як при додаванні 0, 1мл надлишку 0, 1н розчину NaOH, рН розчину буде 10.в випадку метилоранжу розчин буденедотитрований, а в випадку фенолфталеїну – перетитрований.
З усього вказаного випливає правило вибору індикатора: для кожного даного титрування можна застосувати тільки ті індикатори, показники титрування яких лежать в межах стрибка рН на кривій титрування.
Якщо титрувати 0, 01н розчин HCl 0, 01н розчином NaOH, то крива побудована аналогічним способом матиме вигляд. Стрибок рН тут є меншим повеличені і лежить в межах від 5 до 9. тому метиловий оранжевий (рТ=4) і тимолфталеїн (рТ=10) застосовувати вже не можна. Навпаки, метиловий червоний, лакмус, фенолфталеїн підійдуть і в цьому випадку.
Таким чином, величина стрибка рН при титруванні сильних кислот сильними основами (або навпаки)  залежить від концентрації титрованих розчинів; крім того, вона залежить від tо, так як зі зміною tо змінюється ступінь іонізації води. Неважко довести, що із підвищенням tо величина стрибка зменшується.
залежить від концентрації титрованих розчинів; крім того, вона залежить від tо, так як зі зміною tо змінюється ступінь іонізації води. Неважко довести, що із підвищенням tо величина стрибка зменшується.
Перейдемо тепер до титрування слабких кислот сильними основами. При розрахунках рН, звичайно, вже не можна концентрацію Н+-іонів прирівняти до загальної концентрації кислоти в розчині, так як головна її частина присутня у вигляді недисоційованих молекул і тільки незначна частина дисоціює з утворенням Н+.
А) До початку, а рН=рКа-1/2lgCкисл
Б) До т.е. в розчині завжди існують сіль слабкої кислоти і слабка кислота, тобто виникає буферна суміш. рН такої буферної суміші розраховується
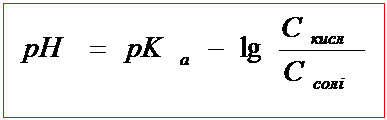
За цією формулою і розраховують проміжні точки на кривій титрування.
В) В точці еквівалентності у розчині у розчині є сіль слабкої кислоти і сильної основи, наприклад Man. Ця сіль гідролізує по
↔ M++An-;
An-+HOH ↔ Han+OH-
Дана рівновага описується константою основності An-:
,
, а [An-]≈ CAn-, тоді.
Тоді, а
Отже, в т.е.
|
Г) Після т.е. до розчину додається надлишок лугу. Останній існує в розчині разом з сіллю, яка утворилась при реакції. Розчин цієї солі вже має лужну реакцію, тобто він повинен ще підвищити рН розчину порівняно з кількостями NaOH, які додаються. Проте, в дійсності підвищення рН, внаслідок гідролізу солі є дуже незначним. Інакше кажучи, можна прийняти, що величина рН визначається винятково присутнім в надлишку лугом NaOH, тобто [OH-]=CNaOH, pOH=-lgCNaOH, a pH=14-pOH=14+lgCNaOH.
Після т.е.
Побудуємо криву титрування 100мл 0.1н розчину ацетатної кислоти, яку титрують 0.1н розчином NaOH.
KaCH3COOH=1, 74·10-5, pKa=4, 76
| ДоданоNaOH, мл | Надлишок, мл | Скисл | розрахунки | рН | |
| кислоти | лугу | ||||
| 100.0 | - | - | 2.88 | ||
| 2.0 | 98.0 | - | 98/2 | pH=pKa-lg | 3.07 |
| 50.0 | 50.0 | - | 50/50 | 4.76 | |
| 90.0 | 10.0 | - | 10/90 | 5.71 | |
| 99.0 | 1.0 | - | 1/99 | 6.76 | |
| 99.9 | 0.1 | - | 0, 1/99, 9 | 7.76 | |
| 100.0 | - | - | - | 8.88 | |
| 100.1 | - | 0.1 | - | 10.0 | |
| 101.0 | - | 1.0 | - | 11.0 | |
| 110.0 | - | 10.0 | - | 12.0 | |
| 200.0 | - | - | 13.0 |
На основі цих даних будуємо, як звичайно, криву титрування.
Порівнюючи цю криву з кривою титрування 0, 1н розчину HCl бачимо, що:
А) т.е. вже не співпадає з значенням pH=7, а знаходиться в області рН> 7, а саме 8, 88;
Б) стрибок рН на кривій титрування менший, ніж при титруванні HCl, а саме знаходиться в межах рН 7, 76(при 0, 7мл надлишку лугу);
Г) при титруванні ацетатної кислоти може бути використаний лише фенолфталеїн, так як його рТ=9 і лежить в межах стрибка титрування.
Причиною зменшення стрибка на кривій титрування оцтової кислоти порівняно з кривою титрування хлоридної кислоти є наступне: CH3COOH, як слабка кислота створює в розчині набагато меншу концентрацію Н+, ніж HCl. Тому і стрибок на кривій титрування починається при більш високому значеннюрН(7, 76), ніж для HCl (рН4). Закінчення титрування в обох випадках однакове (рН=10), так як титрують одним і тим же розчином лугу.
Із сказаного випливає, що чим слабша кислота, яка титрується тим меншим стає стрибок рН кривої титрування.
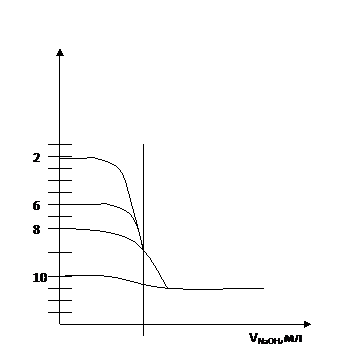 Отже, титрування слабких кислот у водних розчинах ні з одним з індикаторів не можливе.
Отже, титрування слабких кислот у водних розчинах ні з одним з індикаторів не можливе.
Інколи вдається значно збільшити силу слабкої кислоти, вводячи в розчин яку-небудь речовину, яка утворює з нею комплексну кислоту. Наприклад, Н3ВО3 одна з найслабших неорганічних кислот (К=5, 8·10-10) не може бутивідтитрована безпосередньо лугом. Але, якщо до її розчину додати манніт, глюкозу або гліцерин, які утворюють з нею набагато сильніші іонізовані комплекси кислот, то борну кислоту можна відтитрувати достатньо точно з фенолфталеїном.
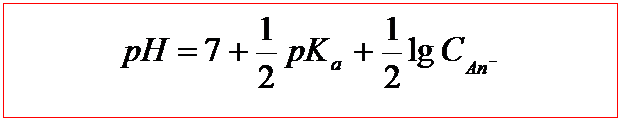 pH=14+lgCNaOH
pH=14+lgCNaOH