
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислотно-основное состояние».
|
|
Нормальное течение жизненных процессов в организме возможно лишь при условиях биохимического постоянства его жизненных сред. Это относительное постоянство внутренней среды организма называют гомеостазом. (Gomeo- однородный, постоянный, stasis-состояние).
Гомеостаз не означает устойчивой неизменности состояния жидкостей организма. Это динамическое, относительное его равновесие. Непрерывно текущие процессы обмена веществ, постоянное поступление извне, а также выведение различных соединений все время приводят к изменению концентрации веществ в жидкостях организма. Удержание относительно постоянного, колеблющегося в узких пределах, состава внутренней среды организма – результат деятельности сложнейшего механизма регуляции, который сложился в процессе эволюции.
Одной из важных сторон гомеостаза является кислотно-основное состояние (КОС) – постоянство соотношения водородных и гидроксильных ионов во внутренней среде организма.
Основным показателем состояния этого баланса является показатель активной реакции крови, который обозначают рН.
У здорового человека рН крови составляет 7, 36 – 7, 44.
Сохранение постоянной слабощелочной реакции внутренней среды организма, несмотря на изменяющиеся условия питания и обмена веществ, на непрерывное образование большого количества кислых продуктов, есть результат постоянной деятельности системы механизмов её регуляции.
Эта регуляция обеспечивается буферными системами. Различают:
1. Химические буферные системы
2. Физиологические (деятельность выделительных органов - (почки, органы дыхания и др.).
К химическим б уферным системам относятся:
1. Бикарбонатный буфер:
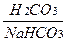
Соотношение это постоянно и равно 1: 20.
Бикарбонатный буфер крови поддерживает постоянство рН в плазме крови, межклеточной жидкости.
2. Фосфатный буфер – соотношение однозамещенной соли фосфорной кислоты к её двузамещенной соли.
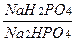
Соотношение это равно 1: 4
В плазме фосфатов значительно меньше, чем бикарбонатов, и поэтому в крови этот буфер имеет небольшое значение.
Он поддерживает рН в тканях, имеет значение в почечной регуляции рН.
3. Белковый буфер – это белки плазмы, которые являются амфолитами (способны в зависимости от реакции среды диссоциировать и как кислоты, и как основания).
4. Гемоглобиновый буфер. Это отношение окисленного гемоглобина к восстановленному гемоглобину 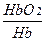 .
.
Большое значение в поддержании рН принадлежит физиологическим механизмам, способствующим выведению избытка катионов и анионов из организма. Среди этих регуляторных приспособлений основная роль принадлежит легким, почкам, печени, ЖКТ и др.
Главная функция легких в поддержании постоянства реакции крови состоит в непрерывном выделении из крови «летучей» угольной кислоты в виде СО2.
При устойчивом состоянии газообмена легкие выводят СО2 столько, сколько его образуется (около 350 г в сутки).
Основными механизмами поддержания постоянства рН со стороны почек являются:
1. Ацидогенез – секреция Н+-ионов эпителием дистальных отделов канальцев нефрона и собирательных трубочек и выведение их с мочой в виде кислот.
Секреция Н+-ионов обеспечивается сложной работой эпителия канальцев нефрона, где постоянно с участием угольной карбоангидразы (КА) из СО2 и Н2О происходит образование угольной кислоты, которая затем диссоциирует на ионы водорода, активно секретируемые в просвет канальцев, и анионы НСО3-. Интенсивность секреции Н+-ионов зависит от рСО2 в крови.
Секретируемые Н+ -ионы связываются в просвете канальцев с анионами и выводятся в виде кислот с мочой, снижая рН мочи.
2. Аммониогенез.
Этот процесс заключается в образовании при дезаминировании аминокислот (больше всего из глютамина) аммиака в эпителии канальцев нефрона, выделении его в просвет канальцев и связывании им Н +-ионов. При этом образуется ион аммония (NН4), который взаимодействует с анионами кислот и образуется аммонийная соль, которая выводится с мочой, не снижая ее рН.
3. Реабсорбция бикарбоната.
Фильтрующийся в клубочках гидрокарбонат обычно не появляется во вторичной моче. Проходя через канальцы, он отдает катион Na взамен на секретируемые ионы водорода и превращается в угольную кислоту, которая расщепляется до СО2 и Н2О. Моча при этом не меняет своей реакции. Оставшийся в клетках после отщепления ионов водорода НСО3- присоединяет реабсорбированный Na+ и в виде NaНСО3 восполняет количество гидро-карбоната крови, ушедшего в мочу при фильтрации.
В почечной регуляции поддержания рН имеет также значение фосфатный буфер.
Na2HPO4 + Н+ < ==> NaH2PO4 + Na+
Катионы Na+ реабсорбируются, в кровь возвращается NaHСО3.
Существование в организме быстро реагирующей сложной системы взаимосвязанных химических и физиологических механизмов, которые сложились в ходе эволюции, обеспечивает поддержание относительно постоянного уровня слабощелочной реакции внутренней среды. Однако под влиянием многих возмущающих воздействий это постоянство может быть нарушено.
Нарушения КОС:
К нарушениям КОС относится:
Ацидоз - это абсолютное или относительное накопление кислот в крови.
Алкалоз - это абсолютное или относительное накопление оснований в крови.
Ацидоз и алкалоз делятся на:
1. компенсированный
2. декомпенсированны
Если буферные системы организма удерживают рН крови в пределах нормальных границ, говорят о компенсированных состояниях.
Когда же химические и физиологические механизмы становятся недостаточными, и реакция крови выходит за пределы крайних нормальных величин, развиваются некомпенсированные состояния.
По механизму развития ацидозы и алкалозы подразделяются на два вида:
- газовый