
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Установка концентрации соляной кислоты по буре
|
|
При взаимодействии соляной кислоты с бурой образуется слабая борная (орто) кислота согласно уравнению:
Nа2В4О7 + 2НС1 +5Н2О = 2NаС1 + 4Н3ВO3.
Для установления концентрации раствора соляной кислоты приготовленным раствором НС1 заполняют чистую, ополоснутую этим раствором кислоты бюретку и устанавливают уровень раствора на нулевой отметке (по нижнему мениску). В коническую колбу для титрования отбирают пипеткой определенный (аликвотный) объем (10, 15 или 20 см3) приготовленного раствора тетрабората натрия, прибавляют 1─ 2 капли индикатора метилового оранжевого и титруют из бюретки раствором кислоты до перехода желтой окраски в оранжево-розовую.
Титрование проводят с соблюдением правил титрования не менее 3 ─ 4 раз до получения воспроизводимых результатов. Результаты титрования записывают в лабораторный журнал (таблица 1), рассчитывают средний объем и вычисляют нормальную концентрацию кислоты, титр и поправочный коэффициент.
Таблица 1– Пример оформления результатов титрования
| Номертит- рова- ния | Взято пипеткой для титрования буры, см3 | Израсходовано титранта из бюретки, см3 | Результаты измерений |
| 10, 54 | 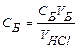
| ||
| 10, 56 | K= 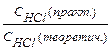
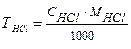
| ||
| 10, 55 |
2. 1. 5 Определение массы соды (Na2CO3) в растворе
Титрование соды проводят в присутствии индикатора метилового оранжевого. При полной нейтрализации лишняя капля соляной кислоты, прибавленная из бюретки, вызывает изменение желтой окраски раствора на розовую. Реакция идёт согласно уравнению:
Na2CO3 + 2НС1 = 2NаС1 + CO2 + H2O.
Ход определения: к полученному для анализа раствору в конической колбе прибавляют 2 капли индикатора и титруют раствором НС1 до появления оранжево-розовой окраски. Титрование повторяют 2─ 3 раза. Расчет проводят по формуле
m(Na2CO3) = ТHCl/Na2CO3 · VHCl;
m(Na2CO3) = 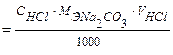 ;
;
Mэ (Na2CO3) = 53, 00 г/моль.