
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение карбонатной жесткости воды
|
|
Карбонатная жесткость воды обусловлена присутствием в ней растворимых солей Са(НСOз)2 и Мg(НСОз)2. При кипячении воды гидрокарбонаты переходят в нерастворимые карбонаты:
Са(НСОз)2 = СаСОз +H2O+CO2;
Мg(НСОз)2 = МgСОз +Н2О+CO2.
Поэтому карбонатная жесткость почти полностью устраняется при кипячении воды. Эту жесткость называют часто временной и обозначают Жв. За единицу жесткости принят 1 моль солей магния и кальция, содержащихся в 1дм3 воды. Кислота взаимодействует с гидрокарбонатами по уравнениям:
Са(НСОз)2 +2НС1=СаСl2+2CO2+2Н2О;
Мg(НСОз)2 + 2НС1 = MgСl2+2CO2+2Н2О;
Количеству израсходованной на титрование кислоты эквивалентно количество солей, определяющих карбонатную жесткость титруемой воды. Так как нормальная концентрация показывает количество моль-эквивалентов растворенного вещества в 1дм3 или миллимоль эквивалентов в 1см3, то произведение концентрации раствора кислоты на число её миллилитров, израсходованное на титрование, равно числу миллимоль ─ эквивалентов солей, обусловливающих жесткость, но содержащихся не в 1дм3, а в объеме, взятом на титрование. Для пересчета необходимо полученный результат увеличить во столько раз, во сколько раз титруемый раствор меньше 1000 см3.
Ход определения: мерную колбу емкостью 100 см3 ополаскивают анализируемой водой и затем наполняют её этой водой до метки. Всю воду из колбы количественно переносят в коническую колбу для титрования, прибавляют 2 капли метилового оранжевого и титруют рабочим раствором НС1 до появления оранжево-розовой окраски. Титрование повторяют три раза. Карбонатную жесткость рассчитывают по формуле
Жв 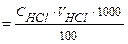 (ммоль-экв/дм3).
(ммоль-экв/дм3).
Содержание отчета
Отчет должен содержать следующие разделы:
- цель работы;
- основные теоретические положения качественного анализа;
- результаты экспериментальных определений;
- таблица с результатами экспериментальных определений;
- выводы о проделанной работе;
- решение задач.
2. 2 Лабораторная работа № 2 «Алкалиметрия» (6 часов)
Метод применяется главным образом для количественного определения кислот и солей, имеющих вследствие гидролиза кислую реакцию. В качестве рабочих растворов используют растворы щелочей (латинск. alkali – щелочь).
Приготовить рабочий раствор щелочи по точной навеске невозможно, т.к. едкие щелочи не удовлетворяют требованиям, предъявляемым обычно к установочным веществам.
Обычно готовят разбавленный раствор щёлочи из концентрированного и устанавливают его концентрацию титрованием по щавелевой H2C2O4 · 2Н2О или янтарной H6C4O4 кислотам.