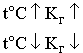Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Факторы, влияющие на степень гидролиза
|
|
Поскольку гидролиз – обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, то давление практически не влияет. Исключается из рассмотрения вода, т.к. ее концентрация в водных растворах практически постоянна (~55 моль/л). Так как гидролиз – равновесный процесс,, то его можно описать количественно при помощи к онстанты гидролиза — константы равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
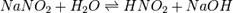
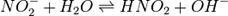
Уравнение константы равновесия для данной реакции будет иметь вид:
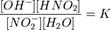 или
или 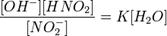
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных  можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:
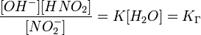
Численное значение константы гидролиза получим, используя ионное произведение воды 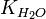 и константу диссоциации азотистой кислоты
и константу диссоциации азотистой кислоты 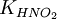 :
:
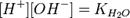
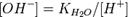
подставим в уравнение константы гидролиза:
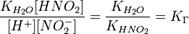
В общем случае для соли, образованной слабой кислотой и сильным основанием:
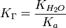 , где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе.
, где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе.
Для соли, образованной сильной кислотой и слабым основанием:
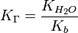 , где Kb — константа диссоциации слабого основания, образующегося при гидролизе.
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе.
Для соли, образованной слабой кислотой и слабым основанием:
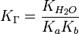
Константа гидролиза зависит от температуры, но не зависит от концентрации раствора