
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сильные электролиты.
|
|
Диссоциация воды. Водородный показатель.
В ода является очень слабым электролитом. (Электролит – вещество, раствор или расплав которого проводит электрический ток). Вода диссоциирует (распадается) на составляющие ее ионы:
H2O ↔ Н+ + ОН-
Ионное произведение воды КW =[ Н+] · [ОН-] = 10 -14 =const (в квадратных скобках условно указана молярная концентрация ионов моль/л). На практике применяют водородный показатель для определения среды. Водородный показатель – отрицательный десятичный логарифм молярной концентрации ионов водорода: рН= - lg [ Н+] и находится в пределах 0< рН< 14
| Ионы в растворе | среда | рН |
| [ Н+] > [ОН-] | Кислая | рН< 7 |
| [ Н+] = [ОН-]=10-7моль/л | Нейтральная | рН= - lg [ Н+] = - lg10-7 = - (- 7) = 7 |
| [ОН-] > [ Н+] | Щелочная | pH > 7 |
| где | рН | где | рН |
| желудок | 1-2 | Дождь | 5, 5-6, 5 |
| кишечник | 8, 5 - 9 | Водопроводная вода | 6-6, 5-7 |
| кожа | 5, 5 -6 | Морская вода | 8-8, 5 |
| кровь | 7, 35-7, 45 | Почва | 4-10 |
Гидролиз
Взаимодействие ионов соли с ионами воды, при котором происходит изменение водородного показателя рН, называется гидролизом. Это обратимая реакция.
Если при растворении соли рН не меняется (остается рН=7), то гидролиз не происходит.
Наличие в соли слабого иона обуславливает гидролиз - именно слабый ион присоединяет к себе противоположно заряженный ион воды, образуя при этом новую частицу (с зарядом или без него), а оставшийся ион воды организует среду: Н+ - кислую, ОН− - щелочную.
Сильные электролиты.
| Сильные кислоты | Сильные основания |
| HCl ↔ Н+ + Cl− | NaOH↔ Na+ + ОН− |
| H2SO4 ↔ 2 Н+ + SO42− | KOH↔ K+ + ОН− |
| HNO3 ↔ Н+ + NO3− |
Если в таблице частицы нет, то это будет слабая частица (слабый ион).
Соль состоит из катиона (положительный ион) и аниона (отрицательный ион):
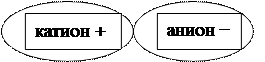
Ме+n К.О.-n (кислотный остаток)
Возможны 4 комбинации соли: 1. сильный + и сильный −
2. сильный + и слабый −
3. слабый + и сильный −
4.слабый + и слабый −
Рассмотрим реакции с такими вариациями ионов:
1.NaCl + H2O гидролиза нет, так как нет слабой частицы в соли, и не меняется рН (равен 7)
 |
силь+силь
реакция нейтральная, и идет диссоциация на ионы: NaCl + H2O ↔ Na++ Cl− + H2O
2. гидролиз соды (технической)
 Na2CO3 + H2O ↔
Na2CO3 + H2O ↔
сильн+слаб






 CO32− + Н+ОН- ↔ Н+CO32− − + ОН- среда щелочная, рН> 7, нужно далее написать в молекулярном виде
CO32− + Н+ОН- ↔ Н+CO32− − + ОН- среда щелочная, рН> 7, нужно далее написать в молекулярном виде
 |  | ||

 Na2CO3 + H2O ↔ Na+ Н+CO32− О + Na+ОН- О
Na2CO3 + H2O ↔ Na+ Н+CO32− О + Na+ОН- О
3. Гидролиз сульфата цинка
 ZnSO4 + H2O ↔
ZnSO4 + H2O ↔
слаб+сильн




 Zn+2 + Н+ОН- ↔ Zn+2ОН- + + Н+ среда кислая, рН< 7, нужно далее написать в молекулярном виде
Zn+2 + Н+ОН- ↔ Zn+2ОН- + + Н+ среда кислая, рН< 7, нужно далее написать в молекулярном виде
 | |||
 |
2ZnSO4 +2H2O ↔ (Zn+2ОН- )+2 SO42- О + Н2+ SO42- О
 |  |
4. гидролиз карбоната алюминия идет до конца, так как соль составлены из двух слабых частиц.
Al2(СO3)3 + 6H2O ↔ 2Al(OH)3 + 3H2CO3
Стандартные электродные потенциалы (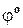 ) металлов (ряд напряжений)
) металлов (ряд напряжений)
| Электродная полуреакция |
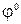 , В , В
| Электродная полуреакция |
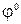 , В , В
|
| Li+ (водн.) + 1e- = Li (тв.) | -3, 045 | Cd2+ (водн.) + 2e- = Cd (тв.) | -0.403 |
Rb+ (водн.) + 1e- =Rb(тв.) 
| -2, 925 | Co2+ (водн.) + 2e- = Co (тв.) | -0.277 |
| K+ (водн.) + 1e- = K (тв.) | -2, 924 | Ni2+ (водн.) + 2e- = Ni (тв.) | -0.250 |
| Cs+ (водн.) + 1e- = Cs (тв.) | -2, 923 | Sn2+ (водн.) + 2e- = Sn (тв.) | -0.136 |
| Ba2+ (водн.) + 2e- = Ba (тв.) | -2, 905 | Pb2+ (водн.) + 2e- = Pb (тв.) | -0.126 |
| Ca2+ (водн.) + 2e- = Ca (тв.) | -2, 866 | Fe3+ (водн.) + 3e- = Fe (тв.) | -0.037 |
| Na+ (водн.) + e- = Na (тв.) | -2.714 | 2H+ (водн.) + 2e- = H2 (г.) | 0.000 |
| Mg2+ (водн.) + 2e- = Mg (тв.) | -2.363 | Sb3+ (водн.) + 3e- = Sb (тв.) | +0.200 |
| Al3+ (водн.) + 3e- = Al (тв.) | -1.663 | Bi3+ (водн.) + 3e- = Bi (тв.) | +0.215 |
| Ti2+ (водн.) + 2e- = Ti (тв.) | -1.630 | Cu2+ (водн.) + 2e- = Сu (тв.) | +0.337 |
| Zr4+ (водн.) + 4e- = Zr (тв.) | -1.539 | Cu+ (водн.) + e- = Cu (тв.) | +0.520 |
| Mn2+ (водн.) + 2e- = Mn (тв.) | -1.179 | Ag+ (водн.) + e- = Ag (тв.) | +0.799 |
| V2+ (водн.) + 2e- = V (тв.) | -1.175 | Hg2+ (водн.) + 2e- = Hg (ж.) | +0.850 |
| Cr2+ (водн.) + 2e- = Cr (тв.) | -0.913 | Pd2+ (водн.) + 2e- = Pd (тв.) | +0, 987 |
| Zn2+ (водн.) + 2e- = Zn (тв.) | -0.763 | Pt2+ (водн.) + 2e- = Pt (тв.) | +1, 188 |
| Cr3+ (водн.) + 3e- = Cr (тв.) | -0.744 | Au3+ (водн.) + 3e- = Au (тв.) | +1, 498 |
| Fe2+ (водн.) + 2e- = Fe (тв.) | -0.440 | Au+ (водн.) + e- = Au (тв.) | +1, 692 |