
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гальванические элементы.
|
|
Гальваническим элементом (ГЭ) называют устройство, в котором энергия химической реакции непосредственно превращается в электрическую. ГЭ состоит из соединенных между собой металлических электродов, погруженных в растворы их соли. Пластины металлов соединены через показывающий прибор. Полуэлементы соединяются в электрическую цепь с помощью трубки, заполненной токопроводящим раствором (так называемого солевого мостика). На рис.1. приведена схема медно-цинкового гальванического элемента (Якоби-Даниэля). − Zn/Zn2+/ /Cu2+/Cu+
 | |||
 | |||










 3
3

 1 5
1 5









 2 4
2 4
Zn Cu















































 - +
- +

ZnSO4 CuSO4
Рис. 1. Схема гальванического элемента:  1 - электрод (Zn); 2- сосуд с раствором ZnSO4; 3 - солевой мостик; 4- сосуд с раствором CuSO4; 5- электрод (Си).
1 - электрод (Zn); 2- сосуд с раствором ZnSO4; 3 - солевой мостик; 4- сосуд с раствором CuSO4; 5- электрод (Си).
Выписываем значения электродных потенциалов для цинка и меди из таблицы №3:
j 0 = 0, 337 В j 0 = − 0, 763 В
Cu2+ / Cu0 Zn2+ / Zn0
 Металл, имеющий меньшее значение электродного потенциала считается анодом и он окисляется.
Металл, имеющий меньшее значение электродного потенциала считается анодом и он окисляется.
Видим, что значение потенциала для цинка меньше, чем для меди, делаем вывод, что цинк
 анод (выполняет функцию отрицательного электрода) А Zn0 - 2ē ® Zn2+
анод (выполняет функцию отрицательного электрода) А Zn0 - 2ē ® Zn2+

Металл, имеющий большее значение электродного потенциала считается к атодом и он восстанавливается.
Реакция на правом электроде для меди, так как он катод (выполняет функцию положительного электрода) соответствует процессу восстановления:
 К Сu2+ + 2ē ® Cu0
К Сu2+ + 2ē ® Cu0
Гальванические элементы изображаются следующей записью:
− Zn0 / ZnSO4 / / CuSO4 / Cu0 + или в ионной форме: − Zn0 / Zn2+ / / Cu2+/ Cu0
в которой вертикальные линии символизируют границу металл - раствор, а двойная - границу между растворами электролитов.
Работа ГЭ оценивается величиной его Э.Д.С.(наибольшее напряжение, которое может дать ГЭ). ЭДС гальванического элемента представляет собой разность электродных потенциалов окислителя и восстановителя, то есть равна разности электродных потенциалов катода и анода.

Е = j К0 − jА 0 (1) Етеор=j Красч − jАрасч
Электродный потенциал металла зависит от концентрации его ионов в растворе.
Эта зависимость выражается уравнением Нернста: 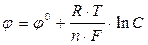
где j - стандартный потенциал металла, R - универсальная газовая постоянная, Т - абсолютная температура, n - число рабочих электронов, переходящих от анода к катоду, F - число Фарадея 1F= 96500 Кл, С - концентрация ионов металла.
Если в приведенном уравнении заменить константы R и F их численным значениями, а натуральный логарифм десятичным, то оно примет следующий вид: 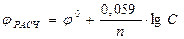
Если концентрации растворов у электродов неодинаковы, то сначала рассчитывают новые значения потенциалов для катода и анода с поправкой на концентрацию по уравнению Нернста, а затем подставляют в уравнение (1).
Концентрационный гальванический элемент (КГЭ) состоит из двух пластин одного металла, погруженных в растворы его соли, которые отличаются лишь концентрацией. − Zn0/Zn2+/ / Zn2+/Zn0+
 | |||
 | |||










 3
3


 1 5
1 5









 2 4
2 4
Zn Zn















































 - +
- +

ZnSO4 ZnSO4
С1 С2 Рис. 2. Схема гальванического элемента:  1, 5 - электроды (Zn); 2, 4 - сосуды с раствором ZnSO4; 3 - солевой мостик.
1, 5 - электроды (Zn); 2, 4 - сосуды с раствором ZnSO4; 3 - солевой мостик.
Электрод, который погружен в раствор с меньшей концентрацией считается анодом.
Допустим, С1 < С2, тогда левый электрод 1 является анодом, а правый электрод 2 будет катодом. КГЭ работает до тех пор, пока не выровняются концентрации С1’= C’2.