
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ионное произведение воды
|
|
ГИДРОЛИЗ СОЛЕЙ
Теоретическое введение
При комнатной температуре вода диссоциирует весьма незначительно (1 из 556 миллионов молекул):
H2O → ← 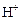 +
+ 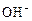
Константа диссоциации воды выражается соотношением:
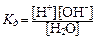
При температуре 25 °С Kд (H2O) = 1, 8· 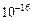 .
.
Количество вещества воды можно определить, разделив массу 1 л воды (1000 г) на ее молярную массу:
ν (H2O) = 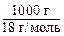 = 55, 56 моль
= 55, 56 моль
Отсюда молярная концентрация воды: [H2O] = 55, 56 моль/л.
Концентрация молекул воды является практически постоянной и ее можно объединить с константой диссоциации:
Kд ·[H2O] = [ 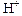 ][
][ 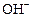 ]
]
Kд ·[H2O] = 1, 8· 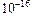 · 55, 56 =
· 55, 56 = 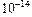 =
= 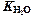
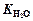 = [
= [ 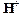 ][
][ 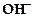 ] =
] = 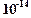
Ионное произведение воды 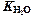 – это произведение концентраций ионов
– это произведение концентраций ионов 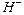 и
и 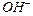 в чистой воде или в любом водном растворе, которое остается постоянным при постоянной температуре. При 25 °С оно равно
в чистой воде или в любом водном растворе, которое остается постоянным при постоянной температуре. При 25 °С оно равно 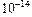 .
.
В чистой воде концентрации катионов водорода 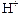 и гидроксид-ионов
и гидроксид-ионов 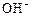 между собой равны:
между собой равны:
[ 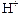 ] = [
] = [ 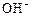 ] =
] = 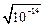 =
= 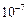 моль/л.
моль/л.
Если в воду добавить кислоту, т.е. ионы 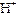 , их концентрация в растворе увеличивается, вызывая уменьшение концентрации ионов
, их концентрация в растворе увеличивается, вызывая уменьшение концентрации ионов 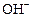 . Такие растворы имеют кислый характер среды.
. Такие растворы имеют кислый характер среды.
При добавлении щелочи, т.е. ионов 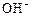 , концентрация этих ионов в растворе увеличивается, вызывая уменьшение концентрации ионов
, концентрация этих ионов в растворе увеличивается, вызывая уменьшение концентрации ионов 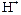 . Такие растворы имеют щелочной характер среды.
. Такие растворы имеют щелочной характер среды.
Растворы, в которых концентрации 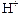 и
и 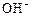 равны, имеют нейтральный характер среды.
равны, имеют нейтральный характер среды.
По концентрации ионов 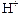 можно определить кислотность среды в растворе, которую количественно определяют водородным показателем рН:
можно определить кислотность среды в растворе, которую количественно определяют водородным показателем рН:
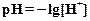
| Нейтральный раствор | [ 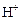 ] = [ ] = [ 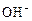 ] = ] = 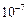
| рН = 7 |
| Кислый раствор | [ 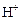 ] > [ ] > [ 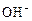 ] > ] > 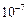
| рН < 7 |
| Щелочной раствор | [ 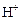 ] < [ ] < [ 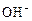 ] < ] < 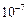
| рН > 7 |
Аналогично рОН = –lg[ 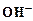 ]
]
Так как [ 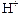 ][
][ 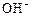 ] =
] = 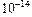 , следовательно рН + рОН = 14.
, следовательно рН + рОН = 14.
Приближенно значение рН можно определить с помощью кислотно-основных индикаторов – слабых органических кислот или оснований, которые существуют в молекулярной (HInd) и ионной (Ind–) формах, имеющих различную окраску в зависимости от рН среды:
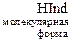
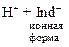
При изменении в растворе концентрации ионов 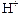 или
или 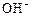 (т.е. рН среды) данное равновесие, по принципу Ле Шателье, смещается в сторону определенной формы индикатора, имеющей характерную окраску.
(т.е. рН среды) данное равновесие, по принципу Ле Шателье, смещается в сторону определенной формы индикатора, имеющей характерную окраску.
Например, молекулярная форма лакмуса, существующая в кислой среде, окрашена в красный цвет, а ионная форма, существующая в щелочной среде – в синий. Этим обусловлена различная окраска лакмуса при разных значениях рН среды.
Изменение окраски каждого индикатора происходит только в определенных интервалах рН, зависящих от его природы.
Важнейшие индикаторы и интервалы их рН перехода:
| Индикатор | Цвет индикатора | ||
| Кислая среда | Нейтральная среда | Щелочная среда | |
| Лакмус | Красный рН < 4, 5 | Фиолетовый рН 4, 5 – 8, 3 | Синий рН > 8, 3 |
| Фенолфталеин | Бесцветный рН < 8, 3 | Бесцветный рН 8, 3 – 9, 8 | Малиновый рН > 9, 8 |
| Метилоранж | Красный рН < 3, 1 | Оранжевый рН 3, 1 – 4, 4 | Желтый рН > 4, 4 |
Универсальный индикатор – смесь индикаторов с разным рН переходом.
Более точно рН раствора определяют с помощью прибора – рН-метра (потенциометра).