
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
III. Влияние температуры
|
|
Налить в пробирку 1 мл раствора ацетата натрия и добавить 1–2 капли фенолфталеина. Отметить интенсивность его окраски.
Нагревать пробирку на спиртовке до изменения интенсивности окраски. Что происходит при охлаждении раствора?
þ Запись результатов опыта:
1. Написать ионное и молекулярное уравнения гидролиза CH3COONa.
2. Записать наблюдаемые явления.
3. Определить характер среды и значение рН раствора.
4. Сделать вывод о влиянии температуры на степень гидролиза.
Опыт № 3. Растворение цинка в продукте гидролиза ZnCl2
Налить в пробирку 2 мл раствора хлорида цинка. Добавить 1‑ 2 капли лакмуса. Отметить изменение окраски индикатора.
Поместить в эту пробирку гранулу цинка. Что происходит?
þ Запись результатов опыта:
1. Написать ионное и молекулярное уравнения гидролиза хлорида цинка по первой ступени.
2. Определить характер среды и значение рН раствора.
3. Определить, с каким из образующихся в процессе гидролиза веществ взаимодействует металлический цинк.
4. Написать ионное и молекулярное уравнение этой реакции.
5. Записать наблюдаемые явления.
Опыт № 4. Гидролиз средней и кислой соли
С помощью лакмуса определить кислотность среды в растворах карбоната и гидрокарбоната натрия.
þ Запись результатов опыта:
1. Составить ионное и молекулярное уравнения гидролиза Na2CO3 по первой ступени.
Написать уравнение диссоциации образующегося иона 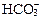 .
.
Kд (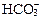 ) = 4, 8 ·
) = 4, 8 · 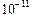
2. Составить ионное и молекулярное уравнения гидролиза NaНCO3 по первой ступени.
Написать уравнение диссоциации образующейся угольной кис-лоты по первой ступени.
Kд (Н2СО3) = 4, 3 · 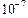
3. Рассчитать значения констант гидролиза K г для Na2CO3 и NaНCO3 по формуле:
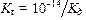
Kд – константа диссоциации иона или молекулы образующихся при гидролизе.
Какая соль больше подвергается гидролизу?
4. Отметить цвет лакмуса в первом и во втором случае. В растворе какой соли среда более щелочная?
5. Какие соли сильнее гидролизуются – кислые или средние?
Опыт № 5. Необратимый гидролиз
В пробирке смешать 1 мл раствора сульфата алюминия и 1 мл раствора карбоната натрия. Что происходит?
þ Запись результатов опыта:
1. Написать ионные уравнения гидролиза ионов 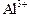 и
и  по всем ступеням и суммарные ионные уравнения гидролиза.
по всем ступеням и суммарные ионные уравнения гидролиза.
2. Составить полное молекулярное уравнение гидролиза Al2(CO3)3, учитывая, что образующаяся в процессе гидролиза угольная кислота распадается на углекислый газ CO2 и воду.
3. Составить молекулярное уравнение реакции взаимодействия сульфата алюминия с карбонатом натрия с учетом полного гидролиза образующейся соли.
4. Записать наблюдаемые явления.