
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
А) в кислому середовищі б) в лужному середовищі
|
|
Будова і забарвлення індикатора фенолфталеїну
А) в кислому середовищі б) в лужному середовищі
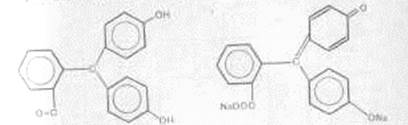
Безбарвний малиновий
Інтервал переходу при рН 8, 0 – 10, 0
рТ = 9, 0
Будова і забарвлення індикатора метилового оранжевого
а) в кислому середовищі б) в лужному середовищі
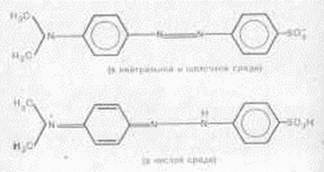
Червоний Жовтий
Основною вимогою при виборі індикатора є близькість значень показника титрування індикатора є близькість значень показника титрування індикатора
(рТ) і рН точки еквівалентності
НInd = Н+ + Ind-
[Н+] [Ind -]
К = ------------------
[HІnd -]
[HІnd -]
pK = pH + Ig -------------
[Ind -]
При зміні концентрації [ H+] відбуваються зміщення рівноваги, яке приводить до збільшення концентрації однієї з форм і зменшення - іншої.
рТ – рН середина інтервалу переходу, коли
[НInd] = [Ind], при цьому:
[HІnd -]
рТ = pK = pH + Ig ------------- = рН
[Ind -]
Таким чином, для вибіру індикатору необхідно знайти індикатор, в якого величина рТ якомога ближча до величини рН в точці еквівалентності.
Як робочі титровані розчини найчастіше використовуються:
Сильні кислоти й основи.
Шляхом безпосереднього титрування можна визначити такі групи електролітів: Сильні і слабкі основи, солі слабких основ і, аналогічно, сильні й слабкі кислоти, а також солі слабких основ і сильних кислот.