
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие
|
|
Необратимые реакции – это реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества. Необратимых или практически необратимых химических реакций меньшинство, в частности к ним можно отнести следующие процессы:
1. Образование нерастворимых и малорастворимых соединений. Например:
– получение осадка BaSO4:
BaCl2(р.) + Na2SO4(р.) ® BaSO4(кр.)¯ + 2NaCl(р.).
2. Образование газообразных веществ с их удалением из сферы реакции. Например:
– получение CO2 в аппарате Киппа:
CaCO3(кр.) + 2HCl(р.) ® CaCl2(р.) + H2O(ж.) + CO2(г.);
– термическое разложение бертолетовой соли (открыта в 1786 г. К.Л. Бертолле):
2KClO3(кр.) 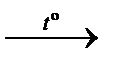 2KCl(кр.) + 3O2(г.).
2KCl(кр.) + 3O2(г.).
3. Образование слабого электролита. Например:
– нейтрализация сильной кислоты сильным основанием:
H2SO4(р.) + 2NaOH(р.) ® Na2SO4(р.) + 2H2O(ж.),
H+ + OH– ® H2O.
4. Образование комплексного соединения. Например:
– получение бромида тетрааминмеди (II):
CuBr2(р.) + 4NH3(р.) ® [Cu(NH3)4]Br2(р.).
5. Реакции, протекающие со значительным избытком реагентов.
Обратимые реакции – это реакции, протекающие в двух направлениях:
– взаимодействие исходных веществ с образованием продуктов реакции (прямая реакция),
– взаимодействие продуктов реакции с образованием исходных веществ (обратная реакция).
Чтобы показать обратимость реакции используют символ ««». Подавляющее большинство химических реакций являются обратимыми. При определённых условиях (Р, V, Т, состав системы и т. д.) в реакционной смеси устанавливается состояние химического равновесия.
Химическое равновесие – это такое состояние обратимого химического процесса, когда скорости прямой и обратной реакций равны. Химическое равновесие характеризуется следующими признаками:
1. при отсутствии внешних воздействий состояние системы остаётся неизменным во времени,
2. при наличии внешних воздействий, сколь бы малы они ни были, система реагирует на эти изменения, переходя в другое состояние равновесия (см. принцип Ле Шателье – Брауна).
Понятие «химическое равновесие» в химии соответствует понятию «термодинамическое равновесие» в термодинамике (см. § 2.4), поэтому для изобарно-изотермических реакций критерием химического равновесия является энергия Гиббса (см. § 2.5):
D GP , T = 0 – обратимая реакция находится в состоянии химического равновесия.
Пример 3.10. Рассчитайте, при какой температуре обратимая реакция
N2(г.) + 3H2(г.) «2NH3(г.)
придёт в состояние химического равновесия? Зависимостью D rH °298 и D rS °298 от температуры пренебречь.
Решение:
Теплоты образования D fН °298 и абсолютные стандартные энтропии S °298 веществ – участников реакции [Равдель]:
| Вещество | N2(г.) | H2(г.) | NH3(г.) |
D fН °298, 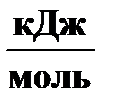
| –45, 94 | ||
S °298, 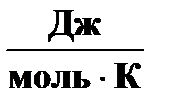
| 191, 50 | 130, 52 | 192, 66 |
По первому следствию из закона Гесса (2.21):
D rН °298 = 2D fН °298(NH3(г.)) – [D fН °298(N2(г.)) + 3D fН °298(H2(г.))] =
= 2 × (–45, 94) = –91, 88 кДж.
По формуле (2.28):
D rS °298 = 2 S °298(NH3(г.)) – [ S °298(N2(г.)) + 3 S °298(H2(г.))] =
= 2 × 192, 66 – [191, 50 + 3 × 130, 52] = –197, 74  .
.
В состоянии химического равновесия D rG °T = 0, тогда из уравнения (2.38):
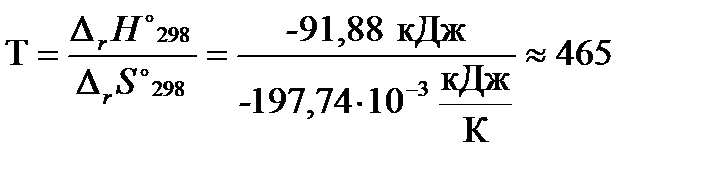 К.
К.
Ответ: реакция придёт в состояние химического равновесия при Т» 465 К.
Заметим, что истинное равновесие является динамическим, т. к. постоянство свойств системы обусловлено не отсутствием процессов на молекулярном уровне, а одинаковой скоростью прямого и обратного процесса. Если какая-либо термодинамическая система не меняется во времени, благодаря отсутствию процессов на молекулярном уровне, но осуществляет обмен веществом или энергией с окружающей средой (например, бассейн с проточной водой), то в такой системе имеет место не равновесное, а стационарное состояние.
В состоянии химического равновесия в реагирующей системе концентрации веществ (т. е. равновесные концентрации) не изменяются. Если реакция происходит в газовой фазе, то данное утверждение справедливо и для равновесных парциальных давлений газов, участвующих в реакции. Отношения концентраций или парциальных давлений в состоянии химического равновесия также постоянны. Допустим, элементарная химическая реакция (3.5) является обратимой:
| n1 А 1 + n2 А 2 « n3 А 3 + n4 А 4 | (3.25) |
В состоянии равновесия скорости прямой и обратной реакций равны uпр = uобр. Тогда, согласно уравнению (3.6):
 , ,
| (3.26) |
где [ A 1], [ A 2], [ A 3], [ A 4] – равновесные концентрации веществ A 1, A 2, A 3, A 4.
Перенеся концентрации в уравнении (3.26) вправо, а константы скорости влево и обозначив 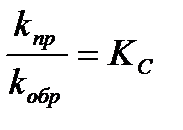 , получим:
, получим:
 , ,
| (3.27) |
Если все вещества в реакции (3.25) находятся в газовой фазе, уравнение (3.27) можно записать в виде:
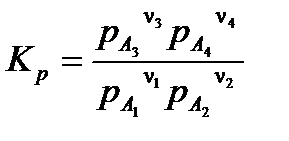 , ,
| (3.28) |
где pA 1, pA 2, pA 3, pA 4 – равновесные парциальные давления веществ A 1, A 2, A 3, A 4.
Таким образом, для химического равновесия закон действующих масс (см. §3.2) может быть сформулирован так:
Отношение произведений равновесных концентраций (или парциальных давлений для газов) продуктов реакций в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций (или парциальных давлений для газов) исходных веществ в степенях, равных стехиометрическим коэффициентам, при постоянной температуре является величиной постоянной.
Величины KC и Kp в уравнениях (3.27) и (3.28) называются константами химического равновесия, а сами уравнения являются одним из математических выражений закона действующих масс. Фазовое состояние вещества в уравнениях (3.27) – (3.28) не указывают. В уравнение (3.27) могут входить концентрации веществ в газовой фазе (г.) и в фазе раствора (р.), в уравнение (3.28) – только в газовой фазе. Концентрации или парциальные давления веществ в твёрдой фазе в уравнения (3.27) – (3.28) не входят, т. к. если реакция протекает на поверхности твёрдого вещества (гетерогенная реакция), С и р этого вещества в ходе реакции не меняются вплоть до полного расходования вещества. Например:
FeO(кр.) + CO(г.) «Fe(кр.) + CO2(г.); 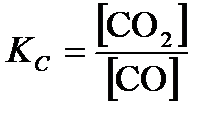 ,
, 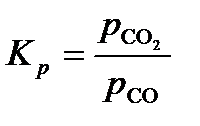 .
.
KC и Kp связаны определённым соотношением. Если принять, что в реакции (3.25), протекающей в газовой фазе, каждое вещество обладает свойствами идеального газа, то используя уравнение Менделеева – Клапейрона (1.6), в состоянии равновесия для вещества А 1 получим:  . Подобные уравнения можно получить и для остальных веществ. Подставив их в уравнение (3.28), получим:
. Подобные уравнения можно получить и для остальных веществ. Подставив их в уравнение (3.28), получим:

| (3.29) |
Учитывая уравнение (3.27), получим:

| (3.30) |
где D n – изменение количества газообразных веществ в ходе реакции.
Таким образом, KC и Kp равны только в случае равенства количества газообразных исходных веществ и продуктов реакции. Например:
– для реакции синтеза хлороводорода H2(г.) + Cl2(г.) «2HCl(г.),  ;
;
– для реакции синтеза аммиака N2(г.) + 3H2(г.) «2NH3(г.),  .
.
Константа химического равновесия зависит от:
- природы реагентов;
- температуры реакционной смеси
и не зависит от:
- давления реакционной смеси (при не очень высоких давлениях),
- концентрации реагентов и продуктов реакции,
- наличия примесей в небольших количествах,
- присутствия катализаторов.
Пример 3.11. При температуре Т = 500 К химическое равновесие в системе
2NO2(г.) «2NO(г.) + O2(г.)
установилось при следующих концентрациях: [NO2] = 0, 006  ; [NO] = 0, 024
; [NO] = 0, 024  . Рассчитайте значения констант равновесия реакции KC и Kp, а также начальную концентрацию С 0(NO2).
. Рассчитайте значения констант равновесия реакции KC и Kp, а также начальную концентрацию С 0(NO2).
Решение:
В соответствии со стехиометрией реакции [O2] =  [NO] =
[NO] = 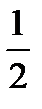 × 0, 024 = 0, 012
× 0, 024 = 0, 012  .
.
По формуле (3.27): 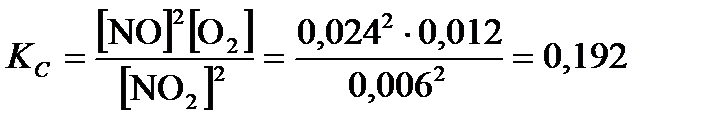 .
.
По формуле (3.30):  .
.
В соответствии со стехиометрией реакции
С 0(NO2) = [NO2] + [NO] = 0, 006 + 0, 024 = 0, 03  .
.
Ответ: KC = 0, 192; Kp» 798; С 0(NO2) = 0, 03  .
.
Пример 3.12. Константа равновесия реакции
FeO(кр.) + CO(г.) «Fe(кр.) + CO2(г.)
при некоторой температуре KC = 0, 5. Рассчитайте равновесные концентрации [CO] и [CO2], если начальные концентрации этих веществ составляли С 0(CO) = 0, 05  ; С 0(CO2) = 0, 01
; С 0(CO2) = 0, 01  .
.
Решение:
Пусть от момента начала реакции до момента наступления равновесия в 1 л реакционной смеси x молей CO превратилось в CO2, тогда: [CO] = (0, 05 – x)  , [CO2] = (0, 01 + x)
, [CO2] = (0, 01 + x)  .
.
По формуле (3.27): 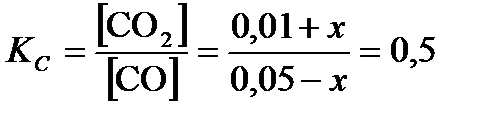 . Отсюда x = 0, 01
. Отсюда x = 0, 01  .
.
Таким образом: [CO] = 0, 05 – 0, 01 = 0, 04  ; [CO2] = 0, 01 + 0, 01 = 0, 02
; [CO2] = 0, 01 + 0, 01 = 0, 02  .
.
Ответ: [CO] = 0, 04  ; [CO2] = 0, 02
; [CO2] = 0, 02  .
.
Константа химического равновесия связана со стандартной энергией Гиббса реакции D rG °T термодинамическим соотношением:
 или
или
 . .
| (3.31) |
Уравнение (3.31) – частный случай уравнения изотермы Вант-Гоффа (выведено Я.Х. Вант-Гоффом в 1884 г.). Для реакций в растворах в уравнение (3.31) входит KC, а для реакций с участием газов – Kp. Из уравнения (3.31) следует:
- при D rG °T < 0 KC (или Kp) > 1, равновесие сдвинуто в сторону прямой реакции;
- при D rG °T > 0 KC (или Kp) < 1, равновесие сдвинуто в сторону обратной реакции.
Таким образом, константа химического равновесия определяет глубину протекания процесса в момент достижения состояния равновесия. Чем больше KC или Kp, тем полнее произошло взаимодействие веществ. Уравнение (3.31) позволяет по величине D rG °T найти константу равновесия, а затем по уравнениям (3.27) или (3.28) рассчитать равновесные концентрации реагентов и продуктов реакции.
Пример 3.13. Стандартная энергия Гиббса реакции
А + В «АВ
D rG °298 = –8  . Начальные концентрации реагентов С 0(А) = С 0(В) = 1
. Начальные концентрации реагентов С 0(А) = С 0(В) = 1  . Рассчитайте константу равновесия реакции KC и равновесные концентрации веществ [ А ], [ В ] и [ АВ ].
. Рассчитайте константу равновесия реакции KC и равновесные концентрации веществ [ А ], [ В ] и [ АВ ].
Решение:
Из формулы (3.31) выразим KC:  .
.
Пусть от момента начала реакции до момента наступления равновесия в 1 л реакционной смеси x молей А и x молей В превратилось в x молей АВ, тогда:
[ А ] = (1 – x)  , [ В ] = (1 – x)
, [ В ] = (1 – x)  , [ АВ ] = x
, [ АВ ] = x  .
.
По формуле (3.27): 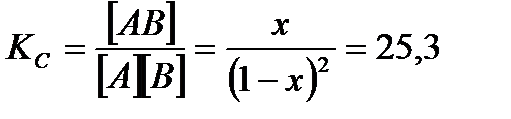 .
.
Отсюда x 1 = 1, 2 (не имеет смысла), x 2 = 0, 82  .
.
[ А ] = [ В ] = (1 – 0, 82) = 0, 18  ; [АВ] = 0, 82
; [АВ] = 0, 82  .
.
Ответ: KC = 25, 3; [ А ] = [ В ] = 0, 18  ; [ АВ ] = 0, 82
; [ АВ ] = 0, 82  .
.
При внешнем воздействии на систему происходит смещение химического равновесия, т. е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Это смещение подчиняется принципу Ле Шателье – Брауна или принципу подвижного равновесия (в 1884 г. установлен А.Л. Ле Шателье, в 1887 г. термодинамически обоснован К.Ф. Брауном):
если система находится в состоянии равновесия, то при действии на неё сил, вызывающих нарушение равновесия, система переходит в такое состояние, в котором эффект внешнего воздействия ослабевает. В частности:
1. Повышение температуры смещает равновесие в сторону поглощения теплоты (т. е. в сторону эндотермической реакции), а понижение температуры – в сторону выделения теплоты (т. е. в сторону экзотермической реакции). Например, в обратимой реакции
2CO(г.) + O2(г.) «2CO2(г.)
прямая реакция является экзотермической (D rH < 0), обратная реакция – эндотермической (D rH > 0). При повышении Т равновесие смещается в сторону образования CO и O2 (обратная реакция), а при понижении Т – в сторону образования CO2 (прямая реакция). Термодинамически это обосновывается следующим образом. Подставив уравнение (2.38) в уравнение (3.31), получим:
 . .
| (3.32) |
Отсюда выразим KC:
 . .
| (3.33) |
Из уравнения (3.33) следует, что в случае прямой экзотермической реакции (D rH < 0) при повышении Т KC будет уменьшаться, т. е. равновесие смещается в сторону обратной (эндотермической) реакции. И наоборот, при понижении Т KC будет увеличиваться, равновесие смещается в сторону прямой (экзотермической) реакции. (Смещение равновесия в зависимости от температуры было установлено Вант-Гоффом ещё до открытия Ле Шателье.)
2. Повышение давления смещает равновесие в сторону уменьшения количества газообразных веществ (т. е. в сторону уменьшения давления), соответственно понижение давления смещает равновесие в сторону увеличения количества газообразных веществ. Например, в обратимой реакции синтеза аммиака
N2(г.) + 3H2(г.) «2NH3(г.)
повышение Р смещает равновесие в сторону прямой реакции, понижение Р – в сторону обратной реакции.
3. Повышение концентрации какого-либо реагента смещает равновесие в сторону расходования данного реагента. Например, в обратимой реакции
FeCl3(р.) + 3KCNS(р.) «Fe(CNS)3(р.) + 3KCl(р.)
образующийся роданид железа (III) Fe(CNS)3 окрашивает раствор в кроваво-красный цвет. При увеличении концентрации одного из исходных веществ (FeCl3 или KCNS) равновесие смещается в сторону прямой реакции (интенсивность окраски раствора усиливается). При увеличении концентрации одного из продуктов (Fe(CNS)3 или KCl) равновесие смещается в сторону обратной реакции (интенсивность окраски ослабевает).