
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Экспериментальная часть. Цель: определение константы скорости инверсии тростникового сахара.
|
|
Цель: определение константы скорости инверсии тростникового сахара.
Порядок выполнения работы.
1. Прежде чем начать работу, следует ознакомиться с поляриметром и упражняться в отсчетах по шкале прибора.
2. Приготовить примерно 20%-ный раствор тростникового сахара, для этого отвесить на технических весах 10 г сахара и, поместив его в 50-мл мерную колбу, довести объем ее водой до метки. Если раствор мутный, нужно отфильтровать. Затем пипеткой или мерным цилиндром отобрать в колбу 25 мл этого раствора и туда же влить 25 мл 6 н. НС1.Смесь перемешать и поместить в термостат при 40° на 3—3, 5 ч.
3. Оставшиеся 25 мл раствора сахара смешать таким же образом с 25 мл раствора кислоты заданной концентрации. Момент сливания кислоты с раствором сахара отметить по часам как момент начала реакции. Смесь тотчас же тщательно перемешать и быстро влить в хорошо вымытую поляриметрическую трубку, предварительно сполоснув ее дистиллированной водой и раза два – небольшим количеством исследуемого раствора. При наполнении трубки нужно следить за тем, чтобы в нее не попал воздух. Пузырьки воздуха вызывают в поле зрения появление темных пятен.
Чтобы быстро заполнить трубку без пузырьков воздуха нужно научиться заполнять ее водой. Трубку наполнить до краев, чтобы жидкость образовала выпуклый мениск, затем осторожно сбоку надвинуть покровное стеклышко и навинтить кольцо, прижимающее стекло к торцу трубки. При этом проверить также, не подтекает ли трубка (не образуется ли пузырьков воздуха через некоторое время после заполнения). Наполненную трубку обтереть снаружи фильтровальной бумагой, обратив особое внимание на чистоту, сухость и прозрачность стекол, закрывающих концы трубки, и поместить в желобок поляриметра в крайнее положение, ближайшее к окуляру.
Отсчеты следует проводить только после получения четкого изображения шкалы и поля зрения при вращении соответствующей муфты на зрительной трубке поляриметра. Все измерения проводить при комнатной температуре с обязательной записью ее до и после опыта. Если измерения проводятся при температурах, отличающихся от комнатной, следует пользоваться поляриметрическими трубками с рубашками для обогрева, подключаемыми к термостату.
4. Угол вращения определяется по полутеневому положению поляриметра сразу после того, как поместили трубку в поляриметр, а потом через различные промежутки времени от начала реакции: 10, 20, 30, 45 и 60 мин. От момента слива растворов сахара и кислоты. Чем больше концентрация катализатора (кислоты), тем чаще следует производить отсчеты углов вращения, постепенно увеличивая время между измерениями. Всего следует сделать 10—12 определений, при этом записывать показание шкалы прибора и соответствующее ему время по часам. Все определения следует проводить по возможности быстро.
5. После всех измерений следует определить угол вращения соответствующий концу реакции. Для этого ту же трубку, в которой находился рабочий раствор, заполнить смесью раствора сахара с 6 н. HCl, предварительно охлажденной до температуры опыта (сполоснуть этим раствором трубку перед заполнением). Отсчет повторить через 30 мин и, убедившись, что угол вращения не меняется, принять его за a∞ . 6. По окончании работы рекомендуется проверить нулевое положение поляриметра, чтобы в случае необходимости ввести соответствующие поправки. Так как кислота разрушает металлическую оправу поляриметрической трубки, необходимо тотчас же после окончания опыта трубку промыть водой и высушить.
6. Результаты наблюдений свести в таблицу по образцу:
Температура опыта
Концентрация HCl
Таблица
| № измерения | Время измерения, час, мин | t, мин | at | a0-a∞ | at-a∞ | k, мин-1 | kсредняя, мин-1 |
Обработка результатов.
1. По результатам опыта вычислить константу скорости реакции при данной температуре для каждого момента, кроме t = 0 и t=∞ по формуле:
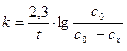 (5)
(5)
В выражение (5) вместо концентрации можно подставить пропорциональные им разности соответствующих углов вращения, тогда:
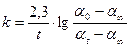 (6)
(6)
где a0 — угол вращения в момент начала реакции; at — угол вращения в данный момент от начала реакции; a∞ — угол вращения, соответствующий концу реакции.
Все значения углов вращения подставляют в уравнение с соответствующими знаками. a∞ имеет отрицательный знак, следовательно, эту величину нужно суммировать с величиной a0.
2.Угол a0, соответствующий моменту начала реакции, практически определить не удается, так как от начала реакции до первого измерения проходит значительное время, поэтому a0 определяется экстраполяцией. На миллиметровой бумаге построить график в координатах «lg (at — a∞ ) — t» (рис.1) и экстраполяцией полученной линии до t = 0 определить lg (a0-a∞ ), а затем рассчитать a0.
lg(at-a∞ )
 | |||
 | |||

 lg(a0-a∞ )
lg(a0-a∞ )
 t, мин
t, мин
Рис. 1. Определение a0
3.Вычислив константы скорости для каждого момента, рассчитать kсредняя.
4. Экспериментальные и расчетные данные занести в таблицу.
Температура опыта
Концентрация HCl
Таблица
| № измерения | Время измерения, час, мин | t, мин | at | a0-a∞ | at-a∞ | k, мин-1 | kсредняя, мин-1 |
5. Определить погрешности прямых и косвенных измерений.
6. Сформулировать вывод.
Литература
1. Белик В.В. Физическая и коллоидная химия. - М.: Академия, 2006.
2. Еремин В.В., Каргов С.И., Успенская И.А. и др. Основы физической химии. Теория и задачи. – М: Издательство «Экзамен». 2005.
3. Стромберг А.Г., Семченко Д.П. Физическая химия.-М.: Высш.шк. 2001.
4. Гельфман М.И. Практикум по физической химии. – СПб.: Издательство «Лань». 2004.