
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая кинетика и катализ
|
|
Исследование гомогенной каталитической реакции
Цель работы: установление зависимости от концентрации катализатора и температуры скорости гомогенной каталитической реакции разложения перекиси водорода:
Н2О2 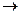 Н2О +1/2 О2
Н2О +1/2 О2
Опыты проводят на установке, схема которой представлена нарис.1.
 Обозначения:
Обозначения:
1- колба реакционная на 150 мл;
2- магнитная мешалка;
3- водяной термостат;
4- магнитопривод;
5- термометр на 100°С;
6- кран или зажим;
7- бюретка на 100 мл
8- уравнительный сосуд;
9-соединительные трубки:
10 - секундомер
Рис. 1. Схема установки
Порядок выполнения работы.
1. В предварительно вымытую хромовой смесью реакционную колбу (1) наливают 100 мл дистиллированной води и заданное количество (от 2 до 8 мл) 3% раствора перекиси водорода и термостатируют в течение 5-10 минут в термостате (3) при включенной мешалке (2).
2. Проверяют герметичность системы, затем открывают кран (6) и с помощью уравнительного сосуда (8) устанавливают уровень воды в бюретке (7) на нулевой отметке. После этого заливают в реакционную колбу заданное количество (от 2 до 8 мл) 30% раствора хлорного железа, быстро и плотно соединяют реактор (1) с бюреткой (7), закрывают кран (6), включают мешалку, запускают секундомер и начинают замер объема выделяющегося кислорода.
3. В первые несколько минут замеры производят через 30 секунд. В последующем через 1-2 минуты, каждый раз предварительно уравнивая уровни воды в бюретке (7) и сосуде (8) путем опускания последнего. Замеры производят в течение 10-30 минут от начала опыта.
4.По заданию преподавателя проводят два опыта при двух различных температурах (20-40°С) и постоянном составе исходной реакционной смеси или два опыта при постоянной температуре и различном количестве катализатора.
5.Экспериментальные данные заносят в таблицу.
Таблица
| Условия I: Т V(H2O2) V(FeCl3) | Условия II: Т V(H2O2) V(FeCl3) | ||
| Продолжительность реакции (t, мин) | Объем выделившегося кислорода (Vt, мл) | Продолжительность реакции (t, мин) | Объем выделившегося кислорода (Vt, мл) |
Обработка результатов
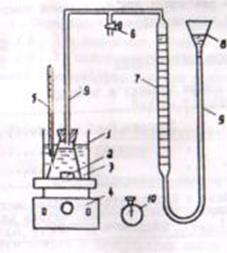
1.Для различных моментов времени от начала реакции (t)вычисляют значения констант скоростей реакции, пользуясь кинетическим уравнением реакции 1-го порядка:
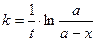 или
или  (1)
(1)
где a - начальное число молей исходного вещества
(a-x)- число молей исходного вещества, оставшегося и цементу времени t;
V∞ - предельный объем выделившегося кислорода, т.е. величина пропорциональная исходному количеству H2O2;
(V∞ - Vt) - объем кислорода, который выделяется при разложении H202, оставшегося в системе к моменту времени t, т.е. величина пропорциональная количеству Н202 в данный момент времени.
2.По средним значениям констант скоростей реакции k1 и k2 для различных температур (T1 иТ2°К) вычисляют величину кажущейся энергии активации реакции
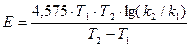 кал (2)
кал (2)
3. Определяют отношение констант скоростей реакции
(k2/k1) и отношение объемов раствора хлорного железа (V2/V1), использованных в соответствующих опытах при постоянной температуре. Две эти величины должны совпасть, т.е.:
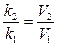 (3)
(3)
4.Определяют погрешности прямых и косвенных измерений.
5. Формулируют вывод.
Литература
1. Белик В.В. Физическая и коллоидная химия. - М.: Академия, 2006.
2. Еремин В.В., Каргов С.И., Успенская И.А. и др. Основы физической химии. Теория и задачи. – М: Издательство «Экзамен». 2005.
3. Шершавина А.А. Физическая и коллоидная химия. Методы физико-химического анализа: Учебное пособие / А.А. Шершавина.- М.: Новое знание, 2005.
4. Стромберг А.Г., Семченко Д.П. Физическая химия.-М.: Высш.шк. 2001.
5. Гельфман М.И. Практикум по физической химии. – СПб.: Издательство «Лань». 2004.