
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача 1. Как изменится скорость прямой реакции (Т = const) 2SO2(г) + O2(г) ↔ 2SO3(г) при увеличении общего давления в реакционном сосуде в три раза?
|
|
Как изменится скорость прямой реакции (Т = const) 2SO2(г) + O2(г) ↔ 2SO3(г) при увеличении общего давления в реакционном сосуде в три раза?
Решение. Из уравнения Клапейрона–Менделеева следует, что Р = n /V∙ RT = CRT, где С - концентрация в моль/л. Согласно закону действующих масс скорость прямой реакции до повышения давления 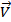 =
= 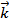 [SO2]2[O2]. После повышения давления в 3 раза концентрация всех газовых компонентов возрастет также в 3 раза, при этом константа скорости реакции останется неизменной, так как она не зависит от концентрации реагирующих веществ.
[SO2]2[O2]. После повышения давления в 3 раза концентрация всех газовых компонентов возрастет также в 3 раза, при этом константа скорости реакции останется неизменной, так как она не зависит от концентрации реагирующих веществ.
Уравнение скорости прямой реакции будет иметь следующий вид:
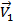 =
= 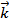 [3SO2]2[3O2] = 27
[3SO2]2[3O2] = 27 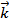 [SO2]2[O2].
[SO2]2[O2].
Таким образом, скорость прямой реакции возрастет в 27 раз.
Задача 2 
Для реакции 2NO2(г) ↔ 2NO(г) + O2(г) константа скорости прямой реакции при 600 К равна 83, 9 л/моль∙ с, а при 645 К она составляет 407 л/моль∙ с. Рассчитать энергию активации этого
процесса.
Решение. Константа скорости реакции связана с энергией активации уравнением Аррениуса
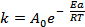
в котором предэкспоненциальный множитель А0 и энергия активации Е а считаются независимыми от температуры. Перейдя к десятичным логарифмам и прологарифмировав уравнение, получим lgk = 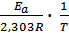 + lgA0. Запишем это уравнение для двух температур:
+ lgA0. Запишем это уравнение для двух температур:
lgk1 = 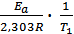 + lgA0 ; lgk2 =
+ lgA0 ; lgk2 = 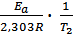 + lgA0 .
+ lgA0 .
Вычитая из второго уравнения первое и решая относительно энергии активации, получим E a = 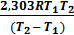 lg
lg 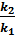 . Подставляя численные значения величин в это уравнение, получим
. Подставляя численные значения величин в это уравнение, получим
Е а= 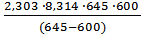 lg
lg 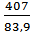 = 113, 2 кДж/моль.
= 113, 2 кДж/моль.