
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Экспериментальная часть. - щавелевая кислота (H2C2O4∙2H20)
|
|
Реагенты:
- щавелевая кислота (H2C2O4∙ 2H20)
- готовый 0.2 N раствор перманганата калия (KMnO4);
- хлорид марганца (II) (MnCl2∙ 4H2O);
- вода дистилированная
Оборудование:
- 3 мерные колбы на 100 мл и одна на 250 мл
- пипетки
- весы
- секундомер
- спектрофотометр UV-mini-1240 Shimadzu
- кварцевая кювета на 1мм
Приготовление рабочих растворов в мерных колбах на 100 мл:
№ 1 0.015 М щавелевая кислота
№ 2 0.0075 М перманганат калия
№ 3 0.0025 М хлорид марганца (II)
Подготовка раствора для спектрофотометрии:
Исследования проводились при температурах 25 °C, 30 °C, 35 °C, 40 °C, каждый раствор должен термостатироваться до нужной температуры. Затем в колбу на 250 мл налить ̴ 200 мл дистиллированной воды и по 5 мл рабочих растворов № 1 и №3. Последним добавить 5 мл рабочего раствора № 2, после приливания сразу включить секундомер. Довести раствор до метки, перемешать. Таким образом, концентрации растворов в реакционной колбе будут:
щавелевой кислоты 0.0003 М 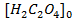 ,
,
перманганата калия 0.00015 М 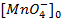 ,
,
хлорида марганца 0.00005 М 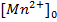 .
.
Налить полученный раствор в кювету, поместить её в спектрофотометр, затем одновременно начать запись кинетики реакции и остановить секундомер, записать время. После окончания регистрации кинетики перенести данные в компьютер.
Обработка данных в Origin.
1. 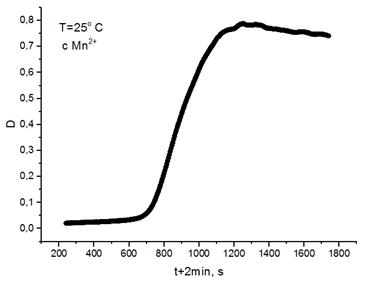 Полученные данные представляют таблицу времени (t, c) и оптической плотности (D). Нужно изменить столбик со временем, прибавив ко всем значениям время засечённое секундомером. Таким образом, можем построить график зависимости оптической плотности от раствора.
Полученные данные представляют таблицу времени (t, c) и оптической плотности (D). Нужно изменить столбик со временем, прибавив ко всем значениям время засечённое секундомером. Таким образом, можем построить график зависимости оптической плотности от раствора.
Оптическая плотность в ходе реакции повышается из-за образования коричневого осадка MnO2. На начальном участке (0-200 с) кривая возрастает слабо, происходит накопление автокатализатора Mn2+, и при достаточной его концентрации реакция идёт намного быстрее. Далее кривая выходит на плато, значение которого фиксируется как D∞ - максимальная оптическая плотность. Здесь заканчивается реакция. Затем начинают собираться более крупные частицы осадка, которые мешают правильной регистрации оптической плотности, поэтому последний участок не представляет интереса.
2. Далее для обработки понадобится вычислить значение  . Для этого берм начальное и максимальное значения оптической плотности, D – текущее значение.
. Для этого берм начальное и максимальное значения оптической плотности, D – текущее значение.
Последняя четвертая добавочная колонка содержит значение 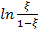
3. Далее были построены графики ξ – t, 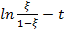 , и аппроксимированы по формулам:
, и аппроксимированы по формулам: 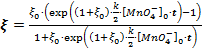 для первого графика и
для первого графика и 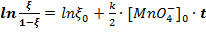 для второго.
для второго.
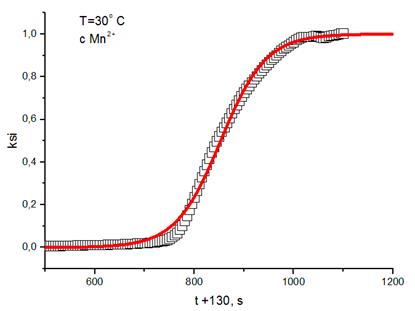
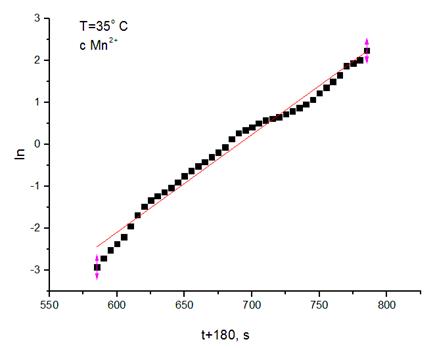
4. Вычисленные значения константы скорости реакции, полученные разными способами:
| T, °C | ξ – t | 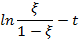
|
| 171 ± 3 | 168 ± 1 | |
| 303 ± 8 | 295 ± 5 | |
| 311 ± 7 | 304 ± 5 | |
| 385 ± 4 | 347 ±5 |
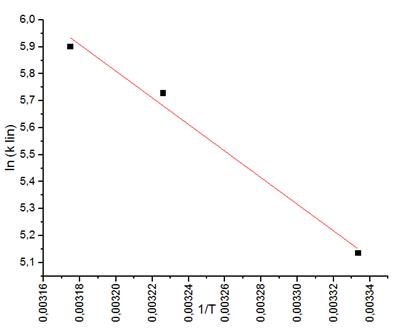
5. Далее можем высчитать энергию активации автокаталитической реакции. Для этого строим график 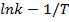 и из значения наклона находим Ea:
и из значения наклона находим Ea: 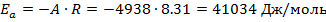
Результаты и выводы.
k(25° C) = 170 ± 3 л/моль*с
k(30° C) = 299 ± 9 л/моль*с
k(35° C) = 308 ± 9 л/моль*с
k(40° C) = 366 ± 6 л/моль*с
Ea = 41 ± 4 кДж/моль
ВЫВОДЫ
Была получена температурная зависимость константы скорости автокаталитической реакции и определена энергия активации данной реакции, Ea = 41 ± 4 кДж/моль
СПИСОК ЛИТЕРАТУРЫ
1. Эмануэль Н. М., Кнорре Д. Г. Курс химической кинетики, 4-е изд., М.: Высш. шк., 1984.
- Практикум по физической химии НГУ Химическая кинетика Под редакцией В.А.Рогова, В.Н.Пармона, Новосибирск, 2013