
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Полный необратимый гидролиз
|
|
Если основание и кислота, образующие соль, являются не только слабыми электролитами, но и малорастворимы или летучи, или неустойчивы и разлагаются с образованием летучих продуктов (Cr2S3, Al2S3, Cr2(CO3)3, Fe2(CO3)3, Al2(CO3)3), то в этом случае гидролиз соли протекает необратимо:
Al2S3 + 6H2O ⇄ 2Al(OH)3↓ + 3H2S↑
Поэтому сульфид алюминия не может существовать в водных растворах, может быть получен только " сухим способом", например, из простых веществ при высокой температуре:
2Al + 3S 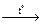 Al2S3
Al2S3
и должен храниться в герметичных сосудах, исключающих попадание влаги.
Необратимому гидролизу подвергаются соли трехвалентных катионов Al3+, Cr3+ и Fe3+ в присутствии карбонатов и сульфидов щелочных металлов:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 6NaCl
Cr2(SO4)3 + 3Na2S + 6H2O → 2Cr(OH)3↓ + 3H2S↑ + 3Na2SO4
Особые случаи гидролиза:
а) соли двухвалентных катионов (кроме Ca2+, Sr2+, Ba2+) в присутствии карбонатов натрия или калия гидролизуются с образованием осадков мало растворимых основных карбонатов и углекислого газа:
2Cu(NO3)2 + 2Na2CO3 + H2O ⇄ (CuOH)2CO3↓ + 4NaNO3 + CO2↑
б) гидролиз солей висмута и сурьмы протекает в две ступени с образованием трудно растворимых солей с катионами типа ВiO+ (висмутил), SbO+(антимонил): SbCl3 + H2O → SbOCl↓ + 2HCl
Механизм процесса можно представить следующим образом:
I-я ступень: SbCl3 + HOH ⇄ SbOHCl2 + HCl
II-я ступень: SbOHCl2 + HOH ⇄ Sb(OH)2Cl¯ + HCl,
полученная на второй ступени основная (гидроксо-) соль разлагается с выделением воды и образованием оксосоли: Sb(OH)2Cl ®SbOCl + H2O.
Аналогичные процессы протекают при гидролизе солей висмута.
в) гидролиз силикатов щелочных металлов протекает с образованием полисиликатов:
I-я стадия 2Na2SiO3 + 2HOH ⇄ 2NaHSiO3 + 2NaOH
2SiO32- + 2HOH ⇄ 2HSiO3- + 2OH-
II-я стадия 2HSiO3- ⇄ Si2O52- + H2O
----------------------------------------------------
Суммарно: 2Na2SiO3 + HOH ⇄ Na2Si2O5 + 2NaOH