
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергии
|
|
53. Ослабить гидролиз соли NH4NO3 можно добавлением:
1) NaOH;
2) NaCl;
HCl;
4) NaCN
54. Уравнение h = 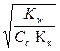 справедливо для соли, образованной:
справедливо для соли, образованной:
1) одноосновной сильной кислотой и однокислотным слабым основанием;
Однокислотным сильным основанием и одноосновной слабой кислотой;
3) однокислотным слабым основанием и одноосновной слабой кислотой;
4) однокислотным слабым основанием и многоосновной сильной кислотой
55. Гидролиз соли NaСN протекает с образованием среды:
Щелочной;
2) нейтральной;
3) слабо кислой;
4) сильно кислой
56. Соль Nа2S гидролизуется:
1) по катиону;
По аниону;
3) по катиону и аниону;
4) не протекает
57. Уравнение: FeCl3+Nа2S+H2O соответствует:
Совместному гидролизу;
2) по катиону;
3) по аниону;
4) гидролиз не протекает
58. Гидролизуется ступенчато:
1) NаСN;
2) K2HPO4;
3) KCl;
4) Cr2S3
59. Верны ли следующие суждения о гидролизе: А - гидролиз- это ионная реакция; Б - при гидролизе могут образоваться два слабых электролита
1) верно только А;
2) верно только Б;
Верны оба суждения;
4) оба суждения неверны
60. При гидролизе кислых солей учитывается:
1) только гидролиз;
2) только диссоциация кислого иона;
Гидролиз и диссоциация;
4) гидратация ионов
61. Концентрация [H] не зависит от концентрации соли в растворе:
1) NH4CH3COO;
2) KCN;
3) NH4ClO4;
4) Nа2S
62. Процесс гидролиза – это:
1) растворение соли в воде;
2) распад вещества на ионы;
3) взаимодействие ионов соли с ионами воды;
Взаимодействие ионов соли с составными частями воды
63. Необратимому гидролизу (с образованием исходной кислоты и основания) подвергается:
1) хлорид натрия;
2) ацетат калия;