
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие.
|
|
Химическое равновесие возникает в обратимых реакциях.
Обратимыми называются реакции, которые протекают в двух взаимно противоположных направлениях.
Например:
Прям
Н 2 + J 2 ⇄ 2НJ
Обр
Таких реакций большинство. Составим кинетические уравнения прямой и обратной реакций.
u пр = k 1 · c H2 · c J2
u обр = k 2 · c 2HJ
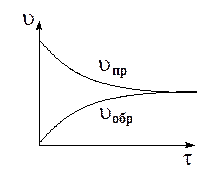 В обратимых реакциях скорость прямой и обратной реакций по-разному изменяются с течением времени. Так, в начальный момент времени скорость прямой максимальна, а скорость обратной реакции практически равна 0, т.к. продукты еще не образованы, а концентрация исходных веществ максимальна. С течением времени скорость прямой реакции будет убывать, а скорость обратной реакции увеличиваться пока не наступит их равенство.
В обратимых реакциях скорость прямой и обратной реакций по-разному изменяются с течением времени. Так, в начальный момент времени скорость прямой максимальна, а скорость обратной реакции практически равна 0, т.к. продукты еще не образованы, а концентрация исходных веществ максимальна. С течением времени скорость прямой реакции будет убывать, а скорость обратной реакции увеличиваться пока не наступит их равенство.
Состояние системы, при котором скорость прямой реакции равна скорости обратной называется химическим равновесием.
u пр = u обр
В условиях равенства скоростей, концентрации исходных веществ и продуктов реакции не изменяются, остаются постоянными и являются равновесными.
Тогда, можно записать k 1 · c H2 · c J2 = k 2 · c 2HJ
Для количественной характеристики состояния равновесия введен безразмерный параметр – константа равновесия. Она равна отношению констант скоростей прямой и обратной реакций.
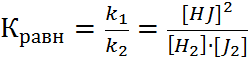
Константа химического равновесия обратимого процесса прямо пропорциональна произведению концентраций продуктов реакции и обратно пропорциональна произведению равновесных концентраций исходных веществ, возведенных в степень равную их стехиометрическим коэффициентам.
К х.р. зависит от природы реагентов и температуры, но не зависит от концентраций и наличия катализатора.
Значение константы определяет преимущество протекания одной из противоположных реакций:
Если К > 1, то в системе выше содержание продуктов, т.е. преимущественно идет прямая реакция. Если К < 1, то в системе выше концентрация исходных веществ и преимущество имеет обратная реакция.
Между константой равновесия и энергией Гиббса существует математическая зависимость:
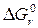 = – RT ln Kравн
= – RT ln Kравн
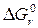 – изменение энергии Гиббса
– изменение энергии Гиббса
R – газовая постоянная
T – температура
Kравн – константа равновесия.
Химическое равновесие носит динамический характер и характеризуется постоянством при неизменности внешних условий.
При изменении концентрации реагентов, температуры и давления скорость одной из реакций может увеличиться, тогда происходит смещение равновесия:
· если возрастает скорость прямой реакции, то равновесие смещается вправо;
· если увеличится скорость обратной реакции, то равновесие смещается влево.
Смещение равновесия определяется принципом Ле-Шателье:

 Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая ослабит это воздействие.
Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая ослабит это воздействие.
ü Влияние концентрации.
При увеличении концентрации исходных веществ равновесие смещается вправо, а при увеличении концентрации продуктов реакции – влево.
ü Влияние температуры.
При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
ü Влияние давления (только для газов и при условии, что количество моль газов исходных веществ и продуктов не равны).
При увеличении давления равновесие смещается в сторону реакции, которая протекает с уменьшением числа моль газов, а при уменьшении давления – в сторону увеличения числа моль газов.