
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм и кинетика радикальной полимеризации.
|
|
Радикальная полимеризация виниловых мономеров CH2=CHX лежит в основе технологии производства разнообразных полимерных материалов. Mеханизм и кинетические закономерности полимеризации интенсивно иизучались в 50-х и 60-х годах; по этому вопросу опубликован ряд монографий. От других цепных реакций полимеризацию отличают следующие две особенности. Во-первых, в результате цепного процесса последовательного присоединения молекул мономера к растущему макрорадикулу происходит материализация многократно повторяющихся актов продолжения цепи в виде конечного продукта -макромолекулы. Во-вторых, ведет цепную реакцию всего один тип активных центров, а именно, макрорадикал со свободной валентностью на углероде. Присоединение мономера CH2=CHX к радикалу R· происходит, как правило, по СH2-группе, так что образуется радикал RCH2C· HX, последующее присоединение идет по типу голова к хвосту, энергетически наиболее выгодному:
RCH3C· HX + CH2=CHX ® RCH2CHXCH2C·HX
Присоединения другого типа (голова к голове и т.д.) протекает лишь в незначительной степени. Например, при полимеризации винилацетата (300-400К) присоединение по типу голова к голове происходит не более, чем в 2% случаев.
| Мономер | СH2=CH2 | CH2=CHOCOCH3 | CH2=CHCOOCH3 | CH2=CHC6H5 |
| - D H·, кДж/моль | 103.2 | 89.0 | 78.2 | 69.4 |
Инициированная полимеризация непредельного соединения включает в себя следующие стадии:
1 
r· + CH2=CHX  rСН2C· HX(R1·)
rСН2C· HX(R1·)
R1· + M 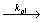 R2·
R2·
Rn· + M 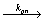 Rn+1·
Rn+1·
Rn· + Rm· 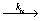 Rn-Rm
Rn-Rm
Rn· + Rm·  RnH + Rm-1CH=CHX
RnH + Rm-1CH=CHX
При выводе кинетических соотношений обычно делаются следующие 4 допущения:
1. Рассматривается случай, когда полимеризация протекает с длинными цепями, т.е.скорость полимеризации v > > v i;
2. Допускается, что k p и k t не зависят от длины реагирующего макрорадикала, т.е. k p1 = k p2=... k pn, и то же для k tc и k td. Такое предположение представляется разумным, особенно
для высокомолекулярных радикалов, так как реакционная способность радикала определяется его молекулярной структурой вблизи свободной валентности, а при гомополимеризации строение всех макрорадикалов одинаково и различаются они только своей длиной.
3. Предполагается протекание реакции в квазистационарном режиме. Это справедливо для экспериментов с v i = const и длительностью t > > t R·, где tR·= (2 k t/ v i)-1/2. При v i = 10-8 - 10-6 моль/л и 2 k t = 106 - 108 л/моль с время жизни макрорадикалов R· меняется в диапазоне 0, 1 -10 с, что значительно короче периода прогрeва реактора (50-200 с).
4. Обычно пренебрегают обрывом с участием первичных радикалов, образующихся из инициатора (этой реакции r· + R· нет в схеме), так как в большинстве случаев практически все r· реагируют с мономером, а доля r·, реагирующих с макрорадикалами, мала, так как [r· ] < < [R· ]. При таких преположениях для скорости полимеризации v и длины кинетической цепи v получаются следующие выражения:
v = k p[M](v i/2 k t)1/2, (1)
n = v / v i = k p[M](2 k t v i)-1/2 (2)
В качестве инициатора полимеризации используются разнообразные пероксидные соединения, азосоединения, полиарилэтаны, дисульфиды. Механизм распада инициатора рассмотрен в Лекции 2.
При распаде инициатора в конденсированной фазе образуются два радикала, окруженные молекулами растворителя или мономера (при полимеризации в массе). Часть таких пар погибает в клетке (вступает в реакции рекомбинации или диспропорционирования), а часть выходит в объем. Если с мономером реагируют все вышедшие в обьем радикалы, то скорость инициирования равна скорости генерирования радикалов: v i = 2 ek d[I]. Если часть радикалов инициатора, вышедших в обьем, реагирует с макрорадикалами, то v i растет с ростом [M], пока не достигает значения 2 ek d[I]. В литературе описаны такого рода примеры. На выход радикалов в объем концентрация мономера практически не влияет, так как рекомбинация радикальных пар в клетке протекает неизмеримо быстрее, чем реакция радикала с мономером.
Обычно инициатор распадается медленно, так что в течение опыта v i = const. Однако встречаются случаи, когда за время опыта распадается его значительная часть. В этом случае при квазистационарном режиме реакции кинетика расходования мономера описывается уравнением:
In 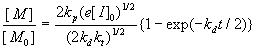 (3)
(3)
Реакция продолжения цепи определяет как скорость полимеризации, так и строение образующегося полимера. Виниловые мономеры полимеризуются по типу голова к хвосту (см. выше). Константа скорости продолжения цепи k p определяется активностью мономера и ведущего цепную реакцию макрорадикала. Ниже приведены константы скорости k p для ряда мономеров:
Стирол: k p = 2.4 ´ 108exp(- 37, 6/RT), л/моль с;
Метилметакрилат: k p = 2.5 ´ 106exp(- 22.6/ RT), л/моль c;
Винилацетат: k p = 2.0 ´ 106exp(- 19.6/ RT), л/моль с;
Метилакрилат: k p = 1.1 ´ 106exp(- 17.6/ RT), л/моль c;
Винилхлорид: k p = 3.3 ´ 106exp(- 36.4/ RT), л/моль с;
Акрилонитрил: k p = 2.3 ´ 105exp(- 16.2/ RT), л/моль с
Присоединение, естественно, протекает с уменьшением энтропии, предэкспоненте 106 л/моль соответствует энтропия активации D¹ S = - 52Дж/(моль л). Мономеры CH2=СHX, содержащие полярную группу (сложноэфирную, нитрильную и т.д.), образуют комплексы с ионами металлов. Например, метилметакрилат образует комплексы состава 1: 1 c солями металлов Li+, Mn2+, Fe3+, Co2+, Zn2+, акрилонитрил-с солями металлов Li+i, Mg+, Fe3+, Mn2+, Co2+, Ni2+. Такие комплексы часто вступают в реакцию с макрорадикалами быстрее. Например, метилметакрилат реагирует с k p = 2.5 ´ 102 л/моль с, а его комплекс c
ZnCl2 - c k p = 6.1 ´ 102л/моль с. Хлористый цинк ускоряет полимеризацию метилметакрилата.
С повышением температуры заметную роль начинает играть реакция деполимеризации, т.е. распада макрорадикала на мономер и радикал
R n · 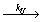 R n-1 · + М
R n-1 · + М
Поскольку реакция роста макрорадикала экзотермична, то реакция деполимеризации эндотермична и разность E U - E p = D H 0. С повышением температуры достигается такое состояние, что скорости роста цепи и деполимеризации становятся равными: k p[R· ][M] = k U[R· ], и скорость полимеризации равна нулю. Этому состоянию соответствует максимальная температура полимеризации, равная:
T max = 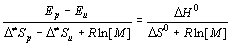 (4)
(4)
Для чистого мономера (при полимеризации в массе) T maх = 583K (стирол), T maх = 493K (метилметакрилат), T maх = 334K (a -метилстирол).
Обрыв цепей, как это видно из схемы, происходит в результате реакции между макрорадикалами. Эти радикалы вступают между собой в реакции двух типов, а именно рекомбинации:
2 ~ CH2-C· XY 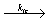 ~CH2- CXY- CXY- CH2~~
~CH2- CXY- CXY- CH2~~
и диспропорционирования:
2~ ~ CH2-C· XY 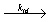 ~~ CH2- CHXY + ~~ CH=CXY
~~ CH2- CHXY + ~~ CH=CXY
2~ ~ CH2-C· XY 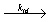 ~~ CH2- CHXY + ~~ CH=CXY
~~ CH2- CHXY + ~~ CH=CXY
От соотношения между константами скорости этих двух реакций зависит средняя степень полимеризации 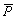 :
:
P = k p[M] 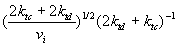 или
или  (5)
(5)
Это соотношение влияет и на молекулярно-массовое распределение: Mw /Mn = 1.5 при рекомбинации R· и Mw /Mn = 2 при их диспропорционировании.
Константы скорости k t = t tc + k td в зависимости от строения мономера меняются в диапазоне 108 - 106 л/моль с. Mежду константой скорости обрыва цепей и вязкостью растворителя существует антибатная зависимость. Это свидетельствует о том, что реакция между двумя макрорадикалами лимитируется диффузионными процессами. Ряд фактов свидетельствует о том, что поступательная диффузия макрорадикалов в растворе не является лимитирующей стадией обрыва цепей при полимеризации. Для макрорадикалов с полярной группой X на конце (~~ CH2CHX) имеет место очевидная симбатность (если не совпадение) между k t и частотой переориентации группы-диполя (Т = 300К).
| X | Cl | Br | C6H4Cl |
| n, c-1 | 2 ´ 108 | 3 ´ 107 | 3 ´ 107 |
| 2 k t, л/моль с | 5 ´ 108 | 2.5 ´ 108 | 7.7 ´ 107 |
По-видимому, в большинстве случаев именно сегментальная подвижность лимитирует скорость и определяет величину константы скорости гибели макрорадикалов.