
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
I. Определение простейшей химической формулы вещества по известным массовым долям элемента.
|
|
Ar – относительная атомная масса элемента (А) и (В).
Mr (Ax By) – относительная молекулярная масса вещества Ax By
ω – массовая доля элемента (компонента) в системе.
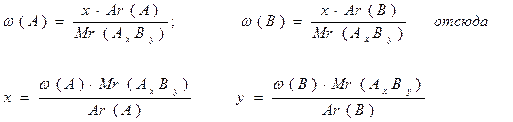 |
Расчетные формулы для определения индексов в химической формуле вещества, например для вещества Ax By:
Отношение x: y равно:
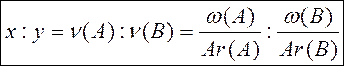 |
Формула для вычисления Mr(в-ва): Mr(в-ва) = D(газа) · Mr(газа)
Расчетные формулы для определения массы химического элемента m(Э) в пропорции вещества:
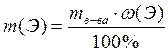
m (Э) = m (в-ва) · ω (Э);
где m (в-ва) – масса вещества;
ω (Э) – массовая доля элемента в веществе.
Выше записанные формулы являются основными при решении задач на определение химической формулы вещества.
Задача 1.
При взаимодействии первичного одноатомного спирта, содержащего 60% углерода и 13, 3% водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна 58. Определите молекулярную формулу каждого из веществ, участвующих в реакции и дайте им названия.
Решение:
1. Вычисляем массовую долю кислорода в спирте:
ω (О) = 100% - (60%+13, 3%)=26, 7%
Определяем соотношение атомов в формуле спирта:
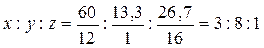 |
Формула спирта CxHyOz
2. Определяем формулу спирта: C3H7OH – пропанол 1
3. Находим молярную массу эфира M = 58 · 2 = 116 г/моль
4. Определяем формулу и даем название кислоты.
Т.к. общая формула сложного эфира R – COOC3H7, то M(R) = 116 – (COOC3H7) = 116 – 87=29 г/моль; значит R – C2H5, что соответствует пропановой кислоте – C2H5COOH.
5. Определяем формулу и название сложного эфира C2H5COOС3H7 – пропилпропионат (или пропиловый эфир пропановой кислоты)
Задачи № 2 – 7 решаются, как и задача № 1.
Задача 2.
При взаимодействии одноатомного спирта, содержащего 52, 17% углерода и 13, 04% водорода, с органической кислотой, образуется вещество, плотность паров которого по водороду равна 51. Определите молекулярную формулу каждого вещества, участвующего в реакции, и дайте им название.
Задача3.
При взаимодействии одноатомного спирта, содержащего 37, 5% углерода, 12, 5% водорода, с органической кислотой образуется вещество, плотность паров которого по водороду равна 37. Определите молекулярную формулу каждого вещества, участвующего в реакции, и дайте им название.
Задача 4.
При взаимодействии одноатомного спирта, содержащего 34, 79% (О), 13, 04% (Н), с органической кислотой, имеющей неразветвленное строение, образовалось вещество, плотность паров которого по водороду равна 58. Определите молекулярную формулу каждого из веществ, участвующих в реакции, дайте им название.
Задача 5.
При взаимодействии одноатомного спирта, содержащего 37, 5% углерода, 50% кислорода, с органической кислотой образуется вещество, плотность паров которого по аргону равна 2, 15. Определите молекулярную формулу каждого из веществ, участвующих в реакции и дайте им название.
Задача 6.
Путресцин содержит 54, 5% (С), 13, 6% (Н), остальное приходится на азот. Плотность его паров по водороду равна 44. Установите молекулярную формулу путресцина. Приведите его структурную формулу, учитывая что молекула имеет неразветвленный углеродистый скелет, а атомы азота максимально удалены друг от друга. Приведите название путресцина по систематической номенклатуре.
Ответ: H2N – CH2 – CH2 – CH2 – CH2 – NH2 – 1, 4 – диаминобутан
Задача 7.
Одно из важнейших химических соединений реагентов, относящихся к классу диаминов, содержит 40% (С), 46, 7% (N), остальное – водород. Установите молекулярную формулу этого органического соединения, приведите его структурную формулу и химическое название.
Ответ: H2N – CH2 – CH2 – NH2 – 1, 2 – диаминоэтан (тривиальное название – этилендиамин)
Задача 8.
Установите формулу неорганического соединения, содержащего 20% магния, 53, 3% кислорода и 26, 67% некоторого элемента. Укажите название этого соединения и класс, к которому оно относится.
Решение: MgxЭyOz
1.
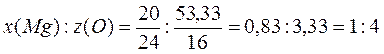 |
Находим соотношение Mg и O:
2. Общая формула вещества MgЭyO4
3.
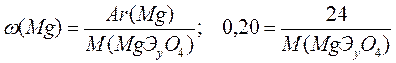 |
Рассчитываем молярную массу соединения, взяв за основу массовую долю магния или кислорода.
M(MgЭyO4) = 120 г/моль
4. Определяем атомную массу неизвестного элемента: 120- (24+Э+64)=32 г/моль или 0, 2667 = Ar(Э)/ 120; Ar(Э) = 32 г/моль => элемент (Э) – сера (S)
5. Формула соединения: MgSO4 – сульфат магния, соль.
Задачи 9 и 10 решаются как задача 8.
Задача 9.
Установите формулу неорганического соединения, содержащего 36, 51% натрия, 38, 09% кислорода и 25, 40% некоторого элемента. Укажите название этого соединения и класс к которому оно относится.
Ответ: Na2SO3 – сульфит натрия, соль.
Задача 10.
Установите формулу неорганического соединения, содержащего 25, 4% серы, 38, 1% кислорода и 36, 5% некоторого элемента. Укажите название этого соединения и класс, к которому оно относится.
Ответ: Na2SO3 – сульфит натрия, соль.