
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Алифатические амины
|
|
Амины - производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Амины классифицируют по числу атомов водорода, замещенных на углеводородные радикалы. Различают первичные R-NH2, вторичные R2-NH и третичные R3-N амины.
В зависимости от типа радикала различают алифатические и ароматические амины:
CH3NH2 CH3CH2NH2 CH2=CH-CH2-NH2 С6H5-NH2
Амины жирного ряда (алифатические амины)
Изомерия в ряду алифатических аминов связана с изомерией углеводородного радикала и количеством заместителей у атома азота.
Многие амины имеют тривиальные названия. По рациональной номенклатуре названия аминов образуются из названий углеводородных остатков, связанных с атомом азота и окончания - амин:
(CH3)2CH-NH2 (CH3)2CHCH2-NH2CH3-NH-CH2CH3
изопропиламин изобутиламин метилэтиламин
По номенклатуре IUPAC для простых аминов используют рациональные названия. По правилам IUPAC к названию углеводородного радикала добавляют окончание - амин. Углеводородная цепь начинается с атома углерода, соединенного с аминогруппой: CH3CH2CH2CH-NH-CH3 1-метилбутиламин
Способы получения алифатических аминов
1. Аммонолиз галогеналканов.
При нагревании галогеналканов со спиртовым раствором аммиака в запаянных трубках образуется смесь соединений. При взаимодействии аммиака с галогеналканами образуются первичные алкиламины. Моноалкиламины являются более сильными нуклеофилами, чем аммиак; они будут дальше реагировать с галогеналканом, давая значительные количества вторичных и третичных аминов и даже четвертичные соли аммония:
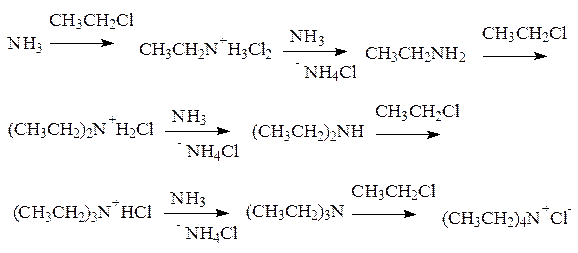
Аммонолиз галогенпроизводных относится к реакциям нуклеофильного замещения. В частности, реакция CH3CH2Cl+NH3 протекает по механизму:
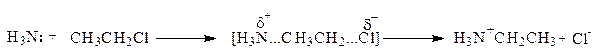
Поэтому первичные амины получают обычно другими способами.
2. Аммонолиз спиртов.
Состоит в замещении атомов водорода в аммиаке или амине на алкильные группы. Это важнейший способ синтеза аминов:
CH3OH + NH3 → CH3NH2 + H2O
Аммонолиз спиртов реализован в значительных масштабах для синтеза низших алифатических аминов (метил- и этиламины). Они применяются в качестве топлива для жидкостных ракетных двигателей и как промежуточные продукты органического синтеза (получение других аминов, диметилгидразина, анионоообменных смол и анионоактивных веществ, пестицидов, карбаматов и дитиокарбаматов).
3. Синтез Габриэля.
Синтез Габриэля позволяет получать первичные амины, свободные от более высокоалкилированных продуктов. Алкилирование фталимида калия по механизму SN2 дает N -алкилфталимид, который можно легко гидролизовать до соответствующего амина:
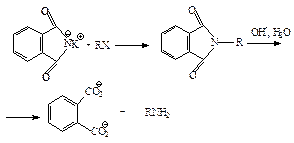
Фталимид получают при нагревании фталевого ангидрида с аммиаком:
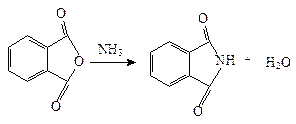
Фталимид обладает кислотными свойствами из-за делокализации отрицательного заряда имид-аниона на двух ацильных атомах кислорода. Он теряет протон, связанный с азотом, при взаимодействии с основанием типа гидроксида калия. В результате этой реакции образуется фталимид-ион – анион, который стабилизируется:
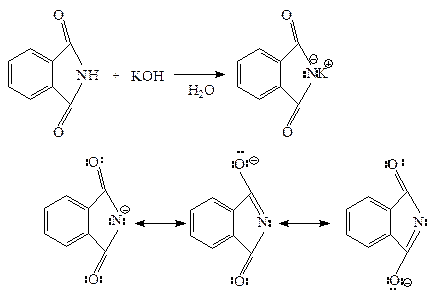
4. Восстановительное аминирование карбонильных соединений
Многие карбонильные соединения превращаются в амины в процессе восстановления в присутствии аммиака. Восстановление осуществляется либо каталитическим гидрированием, либо с помощью цианборгидрида натрия NaBH3CN. Механизм этой реакции включает две важные стадии: образование имина и восстановление имина в амин:
R-COH + NH3 → RH-C=NH + H2O → RH2-C-NH2
CH3(CH2)5CHO + NH3  CH3(CH2)6-NH2
CH3(CH2)6-NH2
Если вместо аммиака использовать первичный амин, то продуктом реакции будет вторичный амин.
5. Восстановление нитроалканов, оксимов, нитрилов, амидов
Азотсодержащие соединения (нитроалканы, оксимы, амиды, нитрилы и изонитрилы) под действием водорода или других восстановителей дают либо первичные амины, либо вторичные, либо их смесь:
R-NO2 + 3 H2 → R-NH2 + 2 H2O
R-CN + 2 H2 → R-NH2 + 2 H2O
R-NC + 2 H2 → R-NH-CH3
Катализаторы – Pt, Pd, Ni.
3. Расщепление амидов кислот (перегруппировка Гофмана).
Амиды алифатических и ароматических карбоновых кислот реагируют со щелочными растворами иода, брома или хлора с образованием первичных аминов. Это так называемая гипогалогенитная реакция Гофмана позволяет не только синтезировать первичные амины, но и укорачивать углеродную цепь на один атом.
Br2 + H2O + RC(O)NH2 + 2 OH - → R-NH2 + CO2 + 2 H2O + 2 Br-

Сначала из стабилизированного резонансом амид-иона образуется N-галогензамещенный амид (здесь N- бромамид), который в щелочном растворе неустойчив и превращается в изоцианат.
Изоцианаты, так же как их углеродные аналоги (кетены), быстро реагируют с водой. Продукт гидратации, карбаминовая кислота, легко декарбоксилируется с образованием амина.
7. Перегруппировка Курциуса.
Хлорангидриды кислот, взаимодействуя с азидом натрия NaN3, дают ацилазиды (азиды кислот), которые при нагревании превращаются в изоцианаты:
R-CO-Cl + NaN3 → R-CO-N-N-N
Превращение ацилазидов в изоцианаты, как показано ниже, представляет собой согласованный процесс. Эта реакция носит название перегруппировки Курциуса:
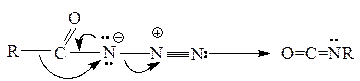
Затем изоцианаты реагируют с водой и образуются амины:
O=C=N-R + H2O → CO2 + R-NH2
Первичные и вторичные амины способны образовывать межмолекулярные водородные связи. Поэтому амины имеют более высокие температуры кипения, чем неполярные соединения с той же молекулярной массой. Спирты и карбоновые кислоты образуют более прочные водородные связи, чем амины. Поскольку третичные амины не содержат водородных атомов при атоме азота, они не образуют водородных связей.
Низкомолекулярные амины смешиваются с водой в любых соотношениях.
Химические свойства аминов
1. Реакции аминов с кислотами
R-NH2 + HCl → R-NH3+Cl -
Эти соли при взаимодействии с водными растворами оснований выделяют амины.
Основность аминов определяется легкостью, с которой амин отщепляет протон от воды.
2. Алкилирование аминов галогеналканами - На последней стадии образуются четвертичные соли аммония - четыре органических группы ковалентно связаны с азотом, положительный заряд уравновешен наличием отрицательного иона:
2 RN+X- + Ag2O + HOH → 2 AgX¯ + OH- + 2 RNOH
Четвертичные аммониевые основания (белые кристаллические вещества) по основности сопоставимы с NaOH, KOH.
4. Ацилирование аминов (получение амидов).
Первичные и вторичные амины реагируют с ангидридами и галогенангидридами кислот с образованием амидов:
CH3CH2NH2 + CH3COCl → CH3CO-NH-CH2CH3 + HCl
(CH3)2NH + (CH3CO)2O → (CH3)2N-COCH3 + CH3COOH
Замещенные амиды называют как производные незамещенных амидов карбоновых кислот.
Образующаяся в ходе реакции кислота связывает эквивалентное количество непрореагировавшего амина. Такой метод становится неэкономичным, если амин трудно синтезировать или он представляет собой дорогостоящий реактив. Поэтому амины часто ацилируют по реакции Шоттен-Баумана, которая заключается во взаимодействии амина и ацилирующего агента в присутствии водного раствора едкого натра:
(CH3)2C-CH2-COCl + R2-NH + OH- → (CH3)2C-CH2-CO-N-R2 + HCl