Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример 1. Используя метод молекулярных орбиталей, объясните различные значения энергии и длины связи в частицах F2 и F2+ Частица Е св
|
|
Используя метод молекулярных орбиталей, объясните различные значения энергии и длины связи в частицах F2 и F2+
| Частица | Е св, кДж/моль | d св× 109, м |
| F2 | 141 | |
| F2+ |
Решение
Процесс образования частицы F2 можно представить записью:
F [1s22s22p5] + F [1s22s22p5] →
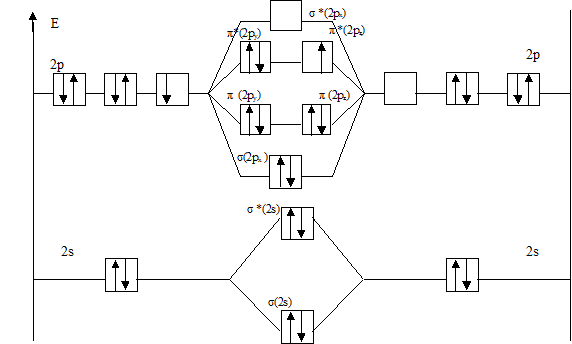
F2 [σ (1s)2 σ *(1s)2 σ (2s)2 σ *(2s)2 σ (2px)2π (2py)2π (2pz)2 π *(2py)2 π *(2pz)2].
Перекрывание 1s- атомных орбиталей приводит к заполнению σ (1s) - связывающей и σ *(1s)- разрыхляющей молекулярных орбиталей двумя электронами с антипараллельными спинами и не изменяет энергию связывающихся атомов и в дальнейшем может не учитываться. В молекуле F2 имеется избыток двух связывающих электронов, что соответствует одинарной связи или порядку связи n, равному единице, который для двухатомной частицы рассчитывается по формуле: 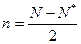 =
= 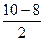 =1, где N – количество связывающих электронов, N* - количество разрыхляющих электронов.
=1, где N – количество связывающих электронов, N* - количество разрыхляющих электронов.
Все электроны в молекуле F2 спарены (спины электронов на отдельных молекулярных орбиталях параллельны) и частица не обладает магнитными свойствами (диамагнитна).
На рис.1 представлена энергетическая диаграмма образования молекулы F2.
Процесс образования частицы F2+ можно представить записью:
F [К2s22p5] + F+ [К2s22p4] →
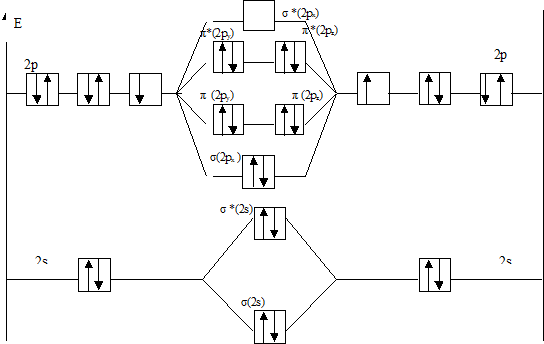
F2+ [ККσ (2s)2 σ *(2s)2 σ (2px)2π (2py)2π (2pz)2 π *(2py)2 π *(2pz)1].
В молекулярном ионе F2+ имеется избыток трех связывающих электронов, что соответствует полуторной связи или порядку связи, равному 1, 5.
Увеличение количества связывающих электронов приводит к упрочнению связи и уменьшению межъядерного расстояния (длины связи). В молекулярном ионе F2+ имеется один неспаренный электрон и частица обладает магнитными свойствами (парамагнитна).
На рис.2 представлена энергетическая диаграмма образования молекулы F2+.
Рис.1 Энергетическая диаграмма молекулы F2
Атомные орбитали Молекулярные орбитали Атомные орбитали
 |  | ||
Рис.2 Энергетическая диаграмма молекулярного иона F2+
Атомные орбитали Молекулярные орбитали Атомные орбитали