
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример 3.
|
|
Определите, к какому структурному типу кристаллической решетки кубической системы (тип СsС1, NaCl или ZnS) относится оксид бария BaO, если известны радиусы ионов и плотность вещества: R кат =1, 36· 10-10м, R анион =1, 40· 10-10м,
ρ = 6, 022 г/см3, укажите координационное число ионов.
Решение. Перечисленные структурные типы отличаются числом формульных единиц в элементарной кубической ячейке (соответственно 1, 4, 4) и соотношением параметра элементарной ячейки (ребра куба) а и межионного расстояния (кратчайшего расстояния) d.
По исходным данным можно определить межионное расстояние d и затем рассчитать параметр элементарной ячейки а для всех трех вариантов. По вычисленному параметру элементарной ячейки рассчитываем плотность вещества и сравниваем с приведенным в условии задачи значением. Определяем структурный тип по совпадению рассчитанного и заданного значения плотности.
Определим межионное расстояние d = R кат + R анион =1, 36 + 1, 40 = 2, 76· 10-10м.
Рассчитаем параметр элементарной ячейки а:
для структурного типа CsCl (объемноцентрированный куб) -
а = 2 d /Ö 3 = 2· 2, 76/1, 732 = 3, 187· 10-10м;
для структурного типа NaCl (примитивный куб) -
а = 2 d = 2· 2, 76 = 5, 52· 10-10м;
для структурного типа ZnS (алмазоподобная решетка) -
а =4 d /Ö 3= 4· 2, 76/1, 732 = 6, 374· 10-10м.
Рассчитываем плотность вещества по формуле r = m/V = (ZM)/(NA a3), где Z – число формульных единиц, M – молярная масса вещества, N A – число Авогадро, a 3 – объем кубической элементарной ячейки:
для структурного типа CsCl -
r = 1· 0, 15334кг/моль / [6, 02· 1023моль-1· (3, 187· 10-10м)3] = 7864 кг/м3=7, 864 г/см3;
для структурного типа NaCl -
r = 4· 0, 15334кг/моль / [6, 02· 1023моль-1· (5, 52· 10-10м)3] = 6053 кг/м3 = 6, 053 г/см3;
для структурного типа ZnS -
r = 4· 0, 15334кг/моль / [6, 02· 1023моль-1· (6, 374· 10-10м)3] =2369 кг/м3 =2, 369 г/см3.
Рассчитанное значение плотности совпадает с заданным только в случае структурного типа NaCl, для которого координационные числа катиона и аниона равны 6.
Раздел «Окислительно-восстановительные реакции»
Одним из методов подбора коэффициентов к окислительно-восстановительной реакции (ОВР) является метод ионно-электронных уравнений (метод полуреакций), в котором уравнения процессов восстановления и окисления, т.е. отдельные полуреакции, записывают с учетом реально существующих в растворе частиц (ионов сильных электролитов, молекул слабых электролитов, газов или труднорастворимых соединений с указанием среды: нейтральной H2O, кислотной H+, щелочной OH-).
В водных растворах связывание или присоединение избыточных атомов кислорода окислителем и восстановителем происходит по-разному в разных средах.
В кислой среде избыток кислорода у окислителя в левой части полуреакции связывается ионами водорода с образованием молекулы воды в правой части, в нейтральной и щелочной средах избыток кислорода связывается молекулами воды с образованием гидроксид- иона по уравнениям:
Ox + a H+ + ze Û Red + b H2O, (кислая среда),
Ox + c H2O+ ze Û Red + d OH-, (нейтральная или щелочная среда),
где Ox – окислитель (например, MnO4-), Red – восстановленная форма окислителя (например, Mn2+), ze – количество электронов, принятое окислителем, a, b, c, d – стехиометрические коэффициенты.
Присоединение избыточного кислорода восстановителем в кислой и нейтральной среде осуществляется молекулами воды с образованием ионов водорода, в щелочной среде – гидроксид-ионами с образованием молекул воды по уравнениям:
Red + a H2O Û Ox + b H + + ze, (кислая или нейтральная среда)
Red + c OH- Û Ox + d H2O + ze, (щелочная среда).
Пример 1. Подберите коэффициенты к ОВР, используя метод ионно-электронных уравнений (метод полуреакций):
KMnO4 + SO2 + KOH ® K2MnO4 + K2SO4 + H2O.
1. Расставив степени окисления атомов, находим окислитель и восстановитель в левой части уравнения
+7 +4 +6 +6
KMnO4 + SO2 + KOH ® K2MnO4 + K2SO4 + H2O
окислитель восстановитель
(Ox) (Red)
2. Записываем уравнения процессов окисления и восстановления, составляя для каждой полуреакции ионно-электронный и материальный баланс (количество одинаковых атомов и сумма зарядов в левой и правой частях полуреакции должно быть равным):
MnO-4 + e Û MnO42-, (процесс восстановления)
SO2 + 4 OH- Û SO42- + 2 H2O + 2 e, (процесс окисления).
В полуреакции окисления молекула SO2 присоединяет два атома кислорода, которые в щелочной среде могут образовывать молекулы воды или OH—ионы.
3. Исходя из электронейтральности веществ в растворе, находим дополнительные множители к наименьшему общему кратному количества участвующих в реакции электронов и суммируем уравнения процессов окисления и восстановления:

 MnO-4 + e ® MnO42- 2
MnO-4 + e ® MnO42- 2
 SO2 + 4 OH- -2 e ® SO42- + 2 H2O 1
SO2 + 4 OH- -2 e ® SO42- + 2 H2O 1
2 MnO-4 + SO2 + 4 OH- ® 2 MnO42- + SO42- + 2 H2O
или в молекулярной форме
2 KMnO4 + SO2 + 4 KOH ® 2 K2MnO4 + K2SO4 + 2H2O.
4. Проводим проверку подобранных коэффициентов по материальному балансу атомов элементов в левой и правой частях уравнения.
Раздел «Химическая термодинамика»
Пример1.
Определите стандартный тепловой эффект реакции
NH3(г) + HCl(г) = NH4Cl(к) при: а) изобарном ее проведении - ∆ r H 0298;
б) изохорном ее проведении - ∆ r U 0298.
Решение. Стандартный тепловой эффект реакции изобарного процесса в соответствии с законом Гесса определяется по уравнению:
∆ r H 0298 = ∆ f H 0298(NH4Cl) - ∆ f H 0298 (NH3) - ∆ f H 0298 (HCl), где ∆ f H 0298 –
стандартная энтальпия образования компонента, приведенная в приложении 1.
Подставим данные и получим:
∆ r H 0298 = (-315, 39) – (-46, 19) – (-92, 30) = - 176, 90 кДж; реакция экзотермическая, т.к. ∆ r H 0298 < 0.
Стандартный тепловой эффект изохорного процесса ∆ r U0298 можно вычислить через стандартный тепловой эффект изобарного процесса по уравнению:
∆ r U 0298 = ∆ r H 0298 – ∆ n · RT, где ∆ n - изменение количества моль газов в реакции. Для данной реакции ∆ n = - n(NH3)- n(HCl) = -1 –1 = -2. Подставим данные и получим:
∆ r U 0298 = - 176, 90.103 – (-2).8, 314.298 = - 171944, 86 Дж @ -172 кДж
Пример 2.
Рассчитайте значение стандартной энтальпии реакции образования хлорида сурьмы (III) из простых веществ по следующим термохимическим уравнениям:
1. Sb(к) + 5/2 Cl2 (г) = SbCl5 (ж) Δ H 0 298, 1 = - 440 кДж
2. SbCl3 (к) + Cl2 (г) = SbCl5 (ж) Δ H 0 298, 2 = - 57 кДж
Решение. Уравнение образования SbCl3 из простых веществ:
Sb(к) + 3/2 Cl2 (г) = SbCl3 (к) (3)
можно получить, если из уравнения (1) вычесть уравнение (2)
Sb(к) + 5/2 Cl2 (г) -SbCl3 (к) - Cl2 (г) = SbCl5 (ж) - SbCl5 (ж)
или Sb(к) + 3/2 Cl2 (г) = SbCl3 (к),
откуда следует, что Δ H 3 = Δ H1- Δ H 2= (- 440) - (- 57) = - 383 кДж или стандартная энтальпия образования 1 моль хлорида сурьмы (III) равна
Δ H 0298 = - 383 кДж/моль
Пример 3.
Рассчитайте энтропию 1моль кремния в растворе меди, в котором его массовая доля w с оставляет 1, 2%, полагая, что раствор является идеальным
Решение. Энтропия 1 моль i–ого компонента в растворе определяется по уравнению: S i¢ = S i0 – Rln x i (1), где Si¢ - энтропия компонента в смеси, Si0 - энтропия чистого компонента, xi – молярная доля компонента, равная для двухкомпонентного раствора отношению количества моль растворенного вещества n1 к сумме количества моль растворенного вещества n1 и растворителя n2:
xi = 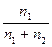 (2). По условию n1 =1, а n2 определим из массовой доли w, равной
(2). По условию n1 =1, а n2 определим из массовой доли w, равной
w = 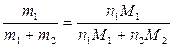 (3), где m1 и m2 – масса растворенного вещества и растворителя, а M1 и M2 – их молекулярные массы. Из уравнения (3) выразим n2: n2 =
(3), где m1 и m2 – масса растворенного вещества и растворителя, а M1 и M2 – их молекулярные массы. Из уравнения (3) выразим n2: n2 = 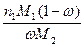 (4) и, подставив в уравнение (2), получим выражение для молярной доли x1:
(4) и, подставив в уравнение (2), получим выражение для молярной доли x1:
xi = 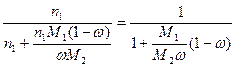 (5).
(5).
Подставим в уравнение (5) данные и найдем численное значение x1
x1 = 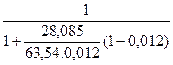 =0, 0267.
=0, 0267.
Энтропия 1 моль кремния равна S 0 =18, 33 Дж/(моль.К), в растворе энтропия 1 моль кремния станет равной S¢ =18, 33-8, 314· ln 0, 0267=48, 45 Дж/(моль.К).
Пример 4.
Для гетерогенной реакции NH3 (г) + HCl (г) = NH4Cl(к)
рассчитайте стандартное изменение энергии Гиббса D r G T 0 и константу равновесия K0 при температуре T=700K. Укажите, в каком направлении протекает реакция при данной температуре и направление смещения равновесия при увеличении температуры. При обосновании направления смещения равновесия используйте
уравнение изобары химической реакции.
Решение. Стандартное изменение энергии Гиббса D r G T 0 может быть вычислено по уравнению: D r G T0 = ∆ r H 0298 - T ∆ r S 0298(1), где ∆ r H 0298 - изменение энтальпии реакции (тепловой эффект реакции) при стандартных условиях, ∆ r S 0298 – изменение энтропии реакции при стандартных условиях.
Расчет ∆ r H 0298 для данной реакции приведен в примере 2, согласно которому
∆ r H 0298= - 176, 9 кДж.
∆ r S 0298 рассчитаем по уравнению: ∆ r S 0298 =S0(NH4Cl) – S0(NH3)- S0(HCl).
Подставляя термодинамические данные из Приложения 1, получим
∆ r S 0298 = 94, 56 - 192, 5 – 186, 7 = - 284, 64 Дж/К.
Стандартное изменение энергии Гиббса Dr G Т0 при T=700K равно:
DrG Т0 = - 176, 9 – 700.(- 284, 64).10-3 = - 92, 1 кДж. Так как DrG Т0 < 0, то реакция самопроизвольно протекает в прямом направлении.
Для расчета константы равновесия используем уравнение: D rG Т0 = - RTlnK0 (2), откуда K0 = exp ( - 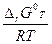 ) = exp (-
) = exp (- 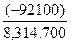 ) = exp(15, 82) и K0 =7, 46.106.
) = exp(15, 82) и K0 =7, 46.106.
Так как константа равновесия K0> > 1, реакция при T=700K протекает в прямом направлении практически необратимо.
Для обоснования направления смещения равновесия при изменении температуры используем уравнение изобары химической реакции:  (3). Так как рассматриваемая реакция является экзотермической (∆ rH0298 < 0), то правая часть уравнения
(3). Так как рассматриваемая реакция является экзотермической (∆ rH0298 < 0), то правая часть уравнения 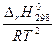 < 0 и с увеличением температуры Т, которая всегда положительна, уменьшается, откуда следует, что и производная
< 0 и с увеличением температуры Т, которая всегда положительна, уменьшается, откуда следует, что и производная 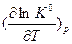 , приобретшая отрицательное значение, с увеличением температуры Т уменьшается, а значит, уменьшается величина константы равновесия К0. Уменьшение константы равновесия означает смещение равновесия реакции влево в сторону образования продуктов реакции, т.к. константа равновесия представляет собой отношение произведения равновесных парциальных давлений продуктов реакции к произведению равновесных парциальных давлений исходных веществ:
, приобретшая отрицательное значение, с увеличением температуры Т уменьшается, а значит, уменьшается величина константы равновесия К0. Уменьшение константы равновесия означает смещение равновесия реакции влево в сторону образования продуктов реакции, т.к. константа равновесия представляет собой отношение произведения равновесных парциальных давлений продуктов реакции к произведению равновесных парциальных давлений исходных веществ: 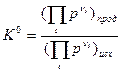 (4). Для данной реакции
(4). Для данной реакции  (парциальное давление твердого вещества NH4Cl(к) незначительно, от давления мало зависит и может быть внесено в константу равновесия) и ее уменьшение означает увеличение знаменателя, т.е. смещение равновесия влево в сторону исходных веществ.
(парциальное давление твердого вещества NH4Cl(к) незначительно, от давления мало зависит и может быть внесено в константу равновесия) и ее уменьшение означает увеличение знаменателя, т.е. смещение равновесия влево в сторону исходных веществ.