
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Точки начала репликации
|
|
Репликация больших геномов эукариот, происходящая в течение относительно короткой S-фазы клеточного цикла, представляется довольно сложной задачей. Каким образом клетка «узнает», что вся ДНК реплицирована? Аппарат репликации эукариот просто не в состоянии двигаться со скоростью достаточной для копирования всей ДНК эукариотических хромосом в пределах предоставленного S-фазой времени и репликация не сможет завершиться, если начнется в одной единственной точке начала репликации, как это имеет место у Escherichia coli. Для успешной и полной репликации эукариоты начинают удвоение ДНК во многих точках начала репликации, которые распределены по хромосомам: у почкующихся дрожжей обнаружено 400 точек начала репликации, а в клетках человека таких точек насчитывается около 60.000. Точки начала репликации расположены так, что вся ДНК может быть реплицирована в относительно короткий предоставленный для этого процесса промежуток времени.
Каким же образом «запуск» всех точек начала репликации согласуется так, что каждая из них активируется раз и только раз в течение S-фазы. Если бы какие-нибудь точки начала репликации активировались больше или меньше одного раза в S-фазе последствия для клетки были бы драматическими: происходили бы дупликация или потеря генов. Согласованная активация точек начала репликации контролируется с помощью механизма называемого «лицензированием». При этом каждая точка начала репликации получает разрешение удвоиться только один раз в течение клеточного цикла. Удвоение каждой конкретной точки начала репликации «снимает лицензию», которая не может быть возобновлена до тех пор, пока клетка не осуществит весь цикл и не пройдет через митоз.
Участок хромосомной ДНК, удвоение которого инициируется в одной точке начала репликации, получил название репликона. Точка начала репликации генетически определяется как репликаторный элемент (или просто репликатор). Классическим репликоном, как упоминалось ранее, является хромосома Escherichia coli: она содержит один единственный сайт-репликатор (т.е. имеет одну точку начала репликации), обозначаемый oriC (рис. в разделе «репликация ДНК E. coli). Начало репликации зависит от участия особых инициаторных белков, часто называемых просто нициаторами, (в случае E. coli это продукт гена DnaA), которые связываются с репликатором (точкой начала репликации) и, прямо или косвенно, способствуют плавлению дуплекса ДНК и предоставляя аппарату репликации, доступ к двум отдельным цепям ДНК. В свою очередь, инициаторы связываются с дополнительными белковыми факторы, совместное действие которых порождает «волну» репликации ДНК, распространяющуюся в двух направлениях от точки начала репликации со скоростью 750–1250 нуклеотидов в секунду.
В противоположность единственной хромосоме E. coli (размером 4´ 106 пар оснований) средние размеры хромосом человека составляют 150´ 106 пар оснований. Поскольку аппарат репликации млекопитающих движется со скоростью всего 20-100 нуклеотидов в секунду (вероятно в связи с нуклеосомной организацией ДНК в хроматине) потребовалось бы 2000 часов для удвоения ДНК такой длины при инициировании процесса в одной точке начала репликации. Для большинства клеток человека длительность S-фазы составляет приблизительно 8 час. Это означает, что для удвоения средней хромосомы в отпущенное время должно использоваться, по меньшей мере, от 25 до 125 точек начала репликации. В действительности точки начала репликации расположены намного более плотно, чем это вытекает из простых расчетов. Так было установлено, что у млекопитающих точки начала репликации расположены на расстоянии приблизительно 100.000 – 150.000 пар оснований друг от друга. Другими словами в удвоении полного генома человека принимает участие около 60.000 точек начала репликации.
В качестве наиболее удачного примера используется рассмотрение событий, происходящих в репликаторах Saccharomyces cerevisiae, поскольку репликация ДНК дрожжей изучена лучше, чем у любых других эукариот.
Точки начала репликации Saccharomyces cerevisiae
Установлено, что в удвоении полного генома дрожжей принимает участие более 400 точек начала репликации. Основное достижение в понимании механизма инициации репликации ДНК у Saccharomyces cerevisiae состояло в идентификации коротких (100-150 пар оснований) сегментов ДНК, которые действуют как точки начала репликации in vivo при их клонировании в дрожжевой плазмиде. Эти сегменты ДНК названные автономно реплицирующимися последовательностями ( a utonomously r eplicating s equences – или ARS - элементы) позволяют дрожжевым плазмидам несущим, например, ген-маркер ответственный за синтез одной из незаменимых аминокислот реплицироваться параллельно с клеточными хромосомами и тем самым обеспечивать рост дрожжевых клеток на селективной среде, не содержащей данной аминокислоты. Сразу после этого было доказано, что именно ARS-элементы, хотя и не все сразу являются истинными точками начала репликации в их естественном окружении в хромосомах. Репликация всегда начинается в пределах ARS-элементов, но не все ARS-элементы действуют как точки начала репликации ДНК в каждом клеточном цикле. Среднее расстояние между репликаторами у дрожжей составляет около 30.000 пар оснований при максимальной протяженности участков между соседними точками начала репликации, равной около 130.000 пар оснований. Даже этот самый протяженный участок должен быть легко реплицирован в течение 30 мин отведенных на S-фазу у дрожжей. Так как общее количество точек начала репликации заметно превосходит то количество, которое необходимое для удвоения дрожжевого генома в отведенный временной интервал, некоторые репликаторы активируются не в каждом клеточном цикле. Вероятность того, что каждая отдельная точка начала репликации будет активирована в конкретном клеточном цикле составляет от менее 0, 2 до более 0, 9. Более детальные исследования позволили установить, что ARS-элементы обладают двумя особенностями, делающими их точками начала репликации. Во-первых, любой ARS-элемент имеет консервативные последовательности, являющиеся связующими сайтами для особого белкового комплекса, который метит ARS-элемент как потенциальную точку начала репликации. Во-вторых, поблизости от указанных связующих сайтов присутствуют последовательности, в пределах которых можно легко вызвать плавление дуплекса ДНК, т.е. разделение пар оснований.
Более подробно, ARS-элементы обладают общей последовательностью ДНК, называемой основной (базовой) последовательностью ARS или ARS - кором (ARS core consensus sequence): 5/-(А/Т)ТТТАТ(А/G)ТТТ(А/Т)-3/. В свою очередь ARS-кор отличает важное свойство: одна единственная замена основания по некоторым положениям в пределах этой последовательности полностью инактивирует весь ARS-элемент. Другие менее консервативные последовательности в этом участке ДНК также влияют на активность ARS как точки начала репликации. Одна из них, обозначаемая В1, вместе с ARS-кором, формирует связующий сайт для комплекса из шести белков, названного комплексом узнавания точки начала репликации ( o rigin r ecognition c omplex или ORC) (см. далее). Первичное разделение цепей ДНК необходимое для инициации репликации происходит в пределах другой короткой последовательности В2. Когда точка начала репликации действительно инициирует удвоение ДНК, синтез дочерних цепей начинается в сайте двунапраленной репликации (ТНДР) как раз посередине между ORC-связующим сайтом и В2-элементом.
Впервые комплекс белков ORC удалось идентифицировать благодаря его способности взаимодействовать с последовательностью ARS-кора, включающей 11 пар оснований. Это взаимодействие характеризуется двумя заслуживающими внимания особенностями. Во-первых, процесс взаимодействия ORC требует присутствия АТР, который остается связанным с комплексом ORC. Связывание АТР стабилизирует комплекс ORC, что позволяет ему принимать участие в последующих процессах сборки предрепликационных комплексов и инициации репликации ДНК. Во-вторых, у дрожжей комплекс ORC постоянно связан с точками начала репликации на протяжении всего клеточного цикла. Таким образом, что-то другое, а не присутствие ORC-комплекса должно участвовать в периодической активации точек начала репликации в S-фазе. У многоклеточных эукариот поведение ORC-комплекса является намного более сложным и изучено плохо.
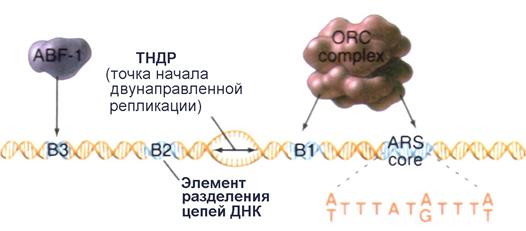
| Рис. 4.16 | Структура элемента ARS1. Белковый комплекс ORC взаимодействует с последовательностью В1 и ARS-кором. Последовательность В2 представляет собой участок ответственный за разделение цепей материнской ДНК. Фактически синтез ДНК начинается в участке, обозначенном ТНДР (точка начала двунаправленной репликации). Последовательность В3 предназначена для связывания вспомогательного фактора ABF-1 являющегося как активатором транскрипции, так и активатором ARS-элементов (Pollard T.D., Earnshaw W.C., Cell Biology, Saunders, 2002). |
В типичных случаях ARS-элементы содержат дополнительные сайты связывания для других, специфичных к определенным ДНК-последовательностям белков, таких как факторы транскрипции. Например, элемент ARS1 включает последовательность В3, которая взаимодействует с фактором транскрипции ABF-1 ( A RS- b inding f actor 1). Однако, как было установлено, делетирование ABF-1-связующего сайта лишь незначительно снижает способность ARS1 действовать в качестве репликатора in vivo. Более того, сам фактор ABF-1 может быть заменен некоторыми другими факторами транскрипции, путем делетирования последовательности В3 и вставки на ее место участка ДНК предназначенного для связывания другого фактора транскрипции. со своими последовательностями в ДНК на взаимодействие с последовательностью В3. В результате таких замен полученные искусственные ARS-элементы реплицируются с эффективностью такой же, как элементы дикого типа.
Оказалось, что между точками начала репликации и промоторными элементами, которые, как известно, ответственны за стимуляцию транскрипции генов, существуют важные функциональные взаимосвязи. В частности, в дополнение к установленной роли гексамерных комплексов ORC в репликации ДНК отдельные компоненты этих комплексов, по-видимому, принимают участие также и в регуляции транскрипции. Действительно, тесное взаимодействие между аппаратами транскрипции и репликации объясняет, почему те области хромосом, с которых активно транскрибируются гены, как правило, рано реплицируются в S-фазе.
Сборка предрепликационного комплекса
Для сохранения целостности генома каждая точка начала репликации должна активироваться («поджигаться») только один раз в ходе клеточного цикла. Хотя механизмы, лежащие в основе регуляции согласованной активации точек начала репликации в клеточном цикле эукариот не до конца понятны, определенные положительные результаты исследования данного процесса у дрожжей все же проливают некоторый свет на понимание принципов функционирования репликаторов.
Как указывалось ранее, дрожжевой комплекс узнавания точки начала репликации – ORC стабильно связан с точкой начала репликации в течение всего цикла дрожжевой клетки. При этом было установлено, что комплекс ORC не является «пусковым устройством» репликации ДНК. Скорее его можно рассматривать как некое «приспособление», на котором собирается белковый комплекс непосредственно ответственный за инициацию репликации ДНК. В течение поздней анафазы или очень ранней фазы G1 с комплексом ORC в точке начала репликации связываются два белка обозначаемые Cdc6p и Cdt1. Образовавшийся тройной комплекс [ ORC · Cdc6p · Cdt1 ] в свою очередь привлекает в точку начала репликации гексамерный комплекс белков Mcm и обеспечивает взаимодействие последнего с ДНК. Образовавшийся комплекс, состоящий из ORC, Cdc6p, Cdt1 и белков комплекса Mcm известен как предрепликационный комплекс (рис. 4.17А). Указанный предрепликационный комплекс собирается в каждой точке начала репликации до наступления фазы S.
Белки Mcm 2-7 формируют гексамерный комплекс, имеющий форму «хомута», который охватывает цепь ДНК. В настоящее время не вызывает сомнения, что гексамер Mcm выполняет функцию ДНК-геликазы – фермента, который используя энергию гидролиза АТР разделяет цепи материнской ДНК.
В настоящее время полагают, что именно сборка предрепликационного комплекса является тем ключевым моментом регуляции репликации, в котором каждая точка начала репликации «получает разрешение» («лицензируется») на инициацию удвоения ДНК так, что инициация происходит только однажды в каждом репликаторе в течение клеточного цикла. Это «лицензирование» реализуется, по крайней мере, посредством трех механизмов.
Первый из них включает регуляцию активности белка Cdc6p с участием киназ Cdk. Так, комплекс белков [Cdc6p · Cdt1] обеспечивает взаимодействие геликазы Mcm с точкой начала репликации в ДНК только в дефосфорилированном состоянии. Протеин-киназной активностью инактивирующей белок Cdc6p обладает фактор SPF ( S phase p romoting f actor), который, как полагают, состоит из специфических пар циклинов Cdk. В клетках млекопитающих они включают Cdk1 или Cdk2 связанные попарно с циклинами Е, А и В; у дрожжей единственный циклин Cdk образует пары с циклинами семейства В-типа.
Второй механизм «лицензирования» точек начала репликации характерен для позвоночных и зависит от белка под названием геминин. Геминин не позволяет комплексу [Cdc6p · Cdt1] обеспечить присоединение белков Mcm к ДНК. В свою очередь белковый комплекс, обозначаемый APC/C способен разрушать геминин, поддерживая его концентрацию на очень низком уровне во время сборки предрепликативных комплексов. Накопление геминина, начинающееся в S-фазе, предотвращает сборку новых предрепликационных комплексов до того момента, пока не завершится фаза митоза. Интересно, что дрожжевые клетки утратили геминин, а, следовательно, и данный механизм «лицензирования».
Третий способ регуляции «лицензирования» точек начала репликации (после наступления S-фазы) заключается в механическом изолировании в цитоплазме белковых факторов необходимых для сборки репликационного комплекса. У дрожжей такими факторами, исключаемыми из ядер после инициации репликации, являются белки Mcm. У позвоночных одним из таких исключаемых факторов является белок Cdt1.