
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 2.2 Углеводороды и их природные источники
|
|
Углеводороды – органические соединения, состоящие из атомов углерода и водорода. Предельные углеводороды называют алканами, парафинами, насыщенными. В их молекулах все связи одинарные. Простейшим представителем алканов является метан.
Гомологический ряд предельных углеводородов имеет следующий вид:
Метан CH4
Этан (C2H6) CH3—CH3
Пропан (C3H8) CH3—CH2—CH3
Бутан (C4H10) CH3—CH2—CH2—CH3
Пентан (C5H12) CH3—CH2—CH2—CH2—CH3
Гексан (C6H14) CH3—CH2—CH2—CH2—CH2—CH3
Гептан (C7H16) CH3—CH2—CH2—CH2—CH2—CH2—CH3
Октан (C8H18) CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3
Нонан (C9H20) CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
Декан (C10H22) CH3—(CH2)8—CH3 и другие.
Радикал – остаток молекулы алкана, лишенный одного водородного атома называют с указанием суффикса – ил. Например: - СН3 метил, - С2Н5 этил.
Составление формулы алкана по его названию идет в обратном порядке по правилам международной номенклатуры ИЮПАК.
Сначала изображают главную цепь и нумеруют ее (как удобно, но лучше слева направо). Затем расставляют заместители к тем атомам углерода, которые указаны в названии. В конце к атомам углерода в главной цепи дописывают недостающие атомы водорода.
К непредельным углеводородам относят алкены, алкадиены, алкины. Непредельные углеводороды – это органические соединения, в молекулах которых валентности атомов углерода не до предела насыщены атомами водорода.
Простейший алкен – этилен (С2Н4 - этен). К непредельным углеводородам ряда этилена относятся органические вещества, в молекулах которых атомы углерода связаны друг с другом двойной связью и отвечающие общей формуле CnH2n. В названиях используется суффикс -ен. Для алкенов характерны реакции присоединения, окисления и полимеризации.
Алкадиенысодержат две двойные углерод – углеродные связи, а в названиях указывается суффикс - диен. Простейший алкадиен – пропадиен (С3Н4).
Алкины – это непредельные углеводороды, молекулы которых содержат одну тройную углерод – углеродную связь, а в названиях веществ указывается суффикс - ин. Простейший алкин – ацетилен (С2Н2 - этин).
Арены или ароматические углеводороды – это углеводороды, в молекулах которых содержится бензольное кольцо. Простейший арен – бензол (С6Н6).
Гибридизация – процесс взаимодействия электронных орбиталей, приводящий к их выравниванию по форме и энергии. Возникающие орбитали называют гибридными, а процесс образования – гибридизацией атомных орбиталей.
Существуют разные способы гибридизации:
1. s p3 гибридизация (в алканах)
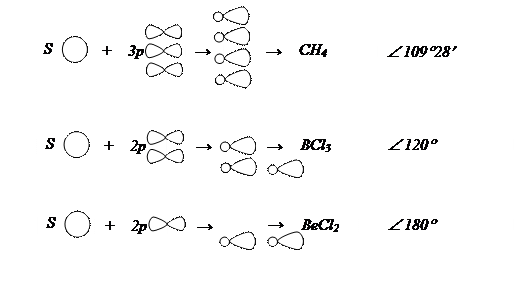 |
2. s p2 гибридизация
3. s p гибридизация
Задания для самоконтроля:
Задание № 1. Напишите структурные формулы соединений по их названиям: а) 2-метилбутан, б) 2-метил-3-этилгептан, в) 1, 4-дихлоргексан, г) 3- метил-6-этилоктан.
Задание № 2. Какие из перечисленных ниже алканов являются изомерами? Напишите их структурные формулы.
а) 3-метилгептан, б) 2-метилгексан, в) 2, 2-диметилгептан, г) 2, 4-диметилгексан, д) 2-метилоктан.
Задание № 3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Назовите вещества.
а) Al4C3 → CH4 → CH3Cl → C2H6 → СО2
б) С2Н6 → С2Н5Cl → С2Н5ОН
↓
СО2
↓
СО
Задание № 4. Найти формулу алкана, если его относительная плотность по водороду равна 22. Назовите его.
Задание № 5. Вещество содержит 20% водорода и 80% углерода. Определить формулу этого вещества, если его молекулярная масса равна 30 г/моль.
Задание № 6. Напишите структурные формулы следующих углеводородов: а) 3-метилпентен-2, б) 2, 5-диметилгексен-1, в) 3, 4, 4-триметилпентен-2, г) 2, 3-диметилгексадиен-2, 4, д) пентадиен-1, 4, е) 3, 3- диметилбутин-1, ж) 4-метил-5-этилоктин-2.
Задание № 7. Назовите вещества по номенклатуре ЮПАК, указав необходимое число атомов водорода.
а) С - С = С - С - С - С
| | |
С С С2
C
|
б) С - С = С - С - С - С
| | |
С С С
C C
| |
в) С - С - С = С - С - С - C
|
С
г) C = C - C д) С - С = С - С - С
| | | |
С С С С
е) С - С - С - С ≡ С
|
C
C C
| |
ж) С - С - С ≡ С - С - С - С
| |
C C
Задание № 8. Напишите уравнения реакций, с помощью которых можно осуществить превращения. Назвать все вещества.
C2H6
↑
С → СН4 → СH3Cl → C2H6 → C2H5Cl → C2H4 → C2H4Cl2
↓
(-CH2-CH2-)n
Задание № 9. Напишите уравнения реакций, с помощью которых можно осуществить превращения.
а) СН4 → А → СН2 =СНCl

 ↓ О
↓ О
 СН3-С
СН3-С
Н
б) СаС2 → С2Н2 → СНОН =СНОН
↓
Ag2C2
в) СН4 → С2Н2 → С6Н6 → С6Н5Cl
Задание № 10. Письменно дайте ответы на следующие вопросы:
а) Что представляет собой нефть? Какие вещества входят в её состав? Назвать основные продукты переработки нефти.
б) Каково значение природного газа в народном хозяйстве? Какие вещества содержатся в природном газе? Напишите формулы. Какие вещества получают?
в) Что такое ректификация нефти?
г) Какие продукты получают из каменного угля?
д) В чем состоит сущность крекинга нефтепродуктов? Какие виды крекинга существуют?
Задание № 11. Составьте, используя текст учебника химии и другие источники, таблицу «Сравнительная характеристика непредельных углеводородов»
Таблица. Сравнительная характеристика непредельных углеводородов
| Признаки | Алкены | Алкадиены | Алкины |
| 1. Общая формула | |||
| 2. Простейший представитель | |||
| 3. Строение молекулы | |||
| 4. Гомологи | |||
| 5. Физические свойства | |||
| 6. Химические свойства | |||
| 7. Применение |
Задание № 12. Прочитайте утверждения и «+» или «-» отметьте каждое соответствие для а) Н2О, б) СО2, в) СН4, г) С2Н2, д) С2Н4.
1) При стандартных условиях газ.
2) Имеет молекулярное строение.
3) Молекула неполярная.
4) Молекула образована только сигма - связями.
5) Не имеет запаха.
6) Вид гибридизации обусловливает плоскую форму молекулы.
7) В молекуле имеются ковалентные полярные связи.
8) Проводит электрический ток.
9) Водный раствор имеет кислотную среду.
10) Взаимодействует с кислотными оксидами.
11) Участвует в жизнедеятельности организмов.
12) Вещество токсично для человека.
13) Применяется для тушения пожаров.
14) Избыточная концентрация ведёт к экологическому кризису.
15) Является основной составной частью атмосферы Марса.
16) Образуется в процессе дыхания.
17) Является причиной возникновения парникового эффекта.
18) Образуется в процессе горения органических веществ.
19) В твёрдом виде носит название «сухой лёд».
20) В чистом виде в природе не существует.