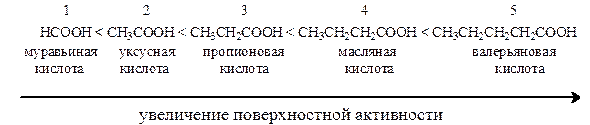Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Адсорбция на подвижных границах раздела фаз
|
|
При растворении различных по природе веществ в жидкой фазе возможны три случая:
1. коэффициент поверхностного натяжения раствора не изменяется: sр-ра = sо, Ds = 0;
2. коэффициент поверхностного натяжения раствора увеличивается: sр-ра > sо, Ds > 0;
3. коэффициент поверхностного натяжения раствора уменьшается: sр-ра < sо, Ds < 0.
В первом и во втором случаях происходит растворение поверхностно – инактивных веществ (ПИАВ), в третьем случае – растворяются поверхностно-активные вещества (ПАВ).
Адсорбция поверхносто-инактивных веществ (ПИАВ)
К ПИАВ относятся вещества с высокой растворимостью в данном растворителе. Для водных растворов это неорганические кислоты, щелочи, соли и органические вещества, содержащие достаточное количество полярных групп и не содержащие неполярные или содержащие малополярные группы: аминоуксусная кислота, глюкоза, мочевина и другие.
При растворении ПИАВ, благодаря их сродству к растворителю, молекулы и ионы стремятся распределиться в объёме раствора таким образом, что в поверхностном слое их концентрация уменьшается. Так при растворении NaCl ионы Na + и Cl – в поверхностном слое способны гидратироваться в меньшей степени. Переход ионов в объем раствора приводит к максимальной их гидратации и значительному уменьшению энтальпии системы, D Н < 0.

Концентрация ионов в поверхностном слое уменьшается, а в объёме – увеличивается Это явление отрицательной адсорбции. Возрастают когезионные силы, что приводит к увеличению коэффициента поверхностного натяжения.
Способность ПИАВ увеличивать коэффициент поверхностного натяжения раствора зависит от
· степени их сольватации
· концентрации ПИАВ в растворе.
В результате адсорбции ПИАВ поверхностная энергия системы увеличивается, D GS > 0. Несмотря на этот факт, отрицательная адсорбция протекает самопроизвольно вследствие уменьшения свободной энергии Гиббса за счёт энтальпийного фактора.
D G = D H – T D S < 0
Адсорбция поверхностно-активных веществ (ПАВ)
Для водных растворов поверхностно-активными веществами являются органические кислоты, высокомолекулярные спирты, соли жирных кислот (мыла), фосфолипиды, белки, сульфокислоты и их соли и другие. Характерной особенностью структуры всех молекул ПАВ является их дифильность. Молекулы ПАВ состоят как из полярных групп, так и неполярных одновременно.
К полярным (гидрофильным) относятся группы, имеющие сродство к полярной жидкости: –ОН, –СООН, –NH 2, =CO, =NH, –SH. Эти группы способны гидратироваться, так как обладают значительным дипольным моментом и обуславливают растворимость ПАВ в воде.
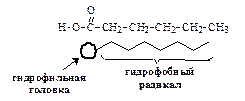 Неполярные (гидрофобные) группы ПАВ могут быть представлены предельными и непредельными углеводородными радикалами и ароматическими кольцами. Они обуславливают пониженную растворимость ПАВ в полярной жидкости.
Неполярные (гидрофобные) группы ПАВ могут быть представлены предельными и непредельными углеводородными радикалами и ароматическими кольцами. Они обуславливают пониженную растворимость ПАВ в полярной жидкости.
Неполярные части молекул ПАВ, не обладая сродством к полярной жидкости, стремятся выйти из раствора, обращаясь в газовую или органическую фазы. Полярные группы остаются в воде и обуславливают растворимость ПАВ.
Таким образом, ПАВ будут ориентироваться в поверхностном слое согласно схеме:
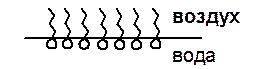
Введение ПАВ в полярную жидкость снижает коэффициент поверхностного натяжения раствора из-за увеличения адгезионных сил.
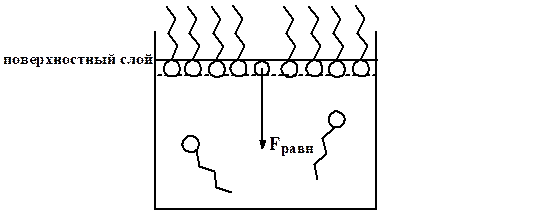
Концентрация ПАВ в поверхностном слое увеличивается, а в объёме – уменьшается. Это явление положительной адсорбции.
Способность ПАВ уменьшать коэффициент поверхностного натяжения зависит от:
· длины углеводородного или ароматического радикалов (правило Дюкло-Траубе)
· концентрации раствора ПАВ
Адсорбция ПАВ с термодинамической точки зрения протекает самопроизвольно, вследствие уменьшения свободной поверхностной энергии, DG S < 0.
Влияние природы ПАВ на их поверхностную активность описывается правилом Дюкло-Траубе:
В гомологическом ряду органических соединений поверхностная активность увеличивается с удлинением их углеводородного радикала; при удлинении цепи на группу –СН 2 – поверхностная активность, а, следовательно, способность к адсорбции в водном растворе возрастает в среднем в 3, 2-3, 4 раза.
Согласно этому правилу предельные органические кислоты по длине гидрофобного радикала и величине их поверхностной активности располагаются в ряд