
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства. Химические свойства спиртов обусловлены наличием полярных связей О–Н и С-О, а также не поделенных электронных пар атома кислорода
|
|
Химические свойства спиртов обусловлены наличием полярных связей О–Н и С-О, а также не поделенных электронных пар атома кислорода. Для спиртов характерны реакции, протекающие с разрывом связи О–Н (образование алкоголятов, этерификация, окисление, дегидрирование, взаимодействие с реактивами Гриньяра), с разрывом связи С–О (нуклеофильное замешение ОН-группы, образование простых эфиров, дегидратация) и протонирование.
1 Кислотно-основные свойства. Спирты являются амфотерн ы ми соединениями.
Кислотность спиртов. Полярность связи О–Н в спиртах определяет ее склонность к гетеролитическому разрыву.
Спирты как ОН-кислоты реагируют со щелочными метатлами с образованием алкоголятов.
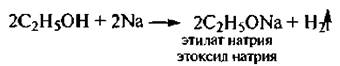
Алкоголяты легко разлагаются водой до исходных спиртов, что подтверждает более низкую кислотность спиртов по сравнению с водой:
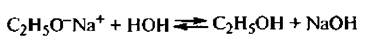
Из-за низкой кислотности спирты почти не вступают в реакцию со щелочами.
Кислотные свойства спиртов уменьшаются при переходе от первичных спиртов к третичным:
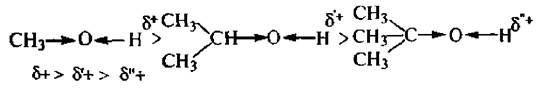
Такая зависимость объясняется прояачением +I-эффекта со стороны углеводородного радикала.
Основные свойства. Обусловлены способностью неподеленных электронных пар атома кислорода гидроксигруппы спиртов реагировать с протоном с образованием оксониевых солей.
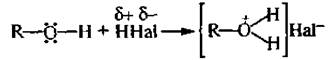
Алкилоксониевые соли во многих реакциях образуются в качестве промежуточных продуктов.
Основные свойства спиртов возрастают при переходе от первичных спиртов к третичным.
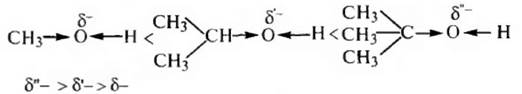
2. Образование сложных эфиров. Спирты реагируют с органическими и кислородсодержащими минеральными кислотами с образованием сложных эфиров.
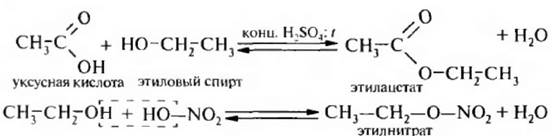
3. Дегидратация спиртов. Для спиртов характерна межмолекулярная и внутри молекулярная дегидратация.
В результате меж молекулярной дегидратации образуются простые эфиры.

Межмолекулярная дегидратация становится доминирующей при нагревании избытка спирта в присутствии каталитических количеств минеральной кислоты при температуре 140-160°С и протекает по механизму SN1 или SN2
Молекула спирта под действием минеральной кислоты иротони-руется с образованием оксониевого катиона, а затем происходит замещение группы –ОН:
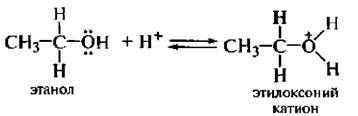
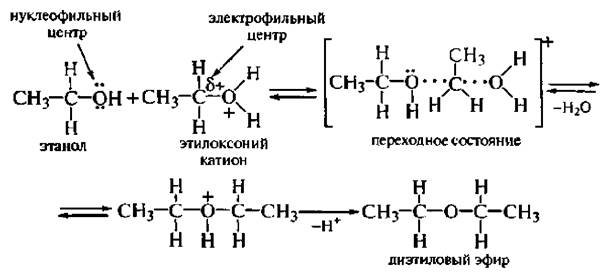
Механизм SN2 включает образование переходного состояния, которое формируется в процессе нуклеофильной атаки электрофильного атома углерода оксониевого катиона второй молекулой спирта:
Механизм SN1 протекает через стадию образования карбкатиона:

Первичные спирты вступают в реакцию межмолекулярной дегидратации по механизму SN2, третичные – по механизму SN1, а вторичные – как по SN2, так и по SNl.
Пгхшуктами внутримолекулярной дегидратации являются алкены.
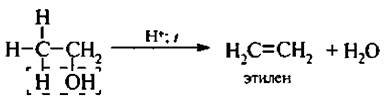
Следует помнить, что спирты, в которых с атомом углерода, несушим гидроксильную группу, связаны неравноценные атомы углерода, отщепление молекулы воды происходит по правилу Зайцева, т. е. водород уходит от соседнего, менее гидрогенизированного атома углерода:
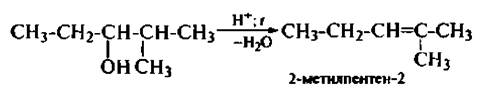
Внутримолекулярная дегидратаиия становится доминирующей реакцией при нагревании спиртов с избытком минеральной кислоты при температуре выше 170 °С.
Следует отметить, что для спиртов более характерны реакции отщепления, протекающие по механизму E1. Это связано с кислотностью реакционной среды, в которой сильное основание – алкоксид-анион RO- не существует, так как быстро взаимодействует с протоном.
Дегидратация третичного спирта протекает по механизму Е1.

4. Взаимодействие с галогеноводородными кислотами. При взаимодействии спиртов с галогеноводородными кислотами (HCl, НВr, HI) гидроксильная группа замешается на атом галогена и образуются галогеноалканы. С первичными спиртами реакция протекает по механизму SN2, с третичными – по SN1, Вторичные спирты реагируют как по механизму SN2, так и по механизму SN1.
Механизм SN2:
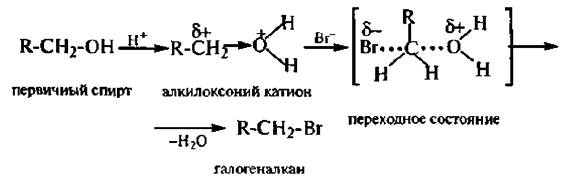
Механизм SNl:
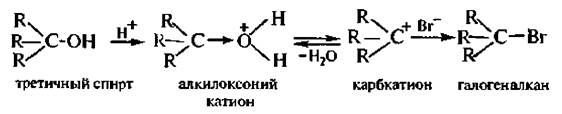
С йодоводородной и бромоводородной кислотами реакция протекает легко, с хлороводородной – значительно труднее. Первичные и вторичные спирты реагируют с хлороводородной кислотой только в присутствии хлорида цинка (кислоты Льюиса).
Первичные, вторичные и третичные спирты при взаимодействии с реактивом Лукаса (эквимолярным и количествами концентрированной хлороводородной кислоты и цинка хлорида) с различной скоростью образуют галогенопроизводные углеводородов. Проба Лукаса используется для распознавания первичных, вторичных и третичных спиртов.
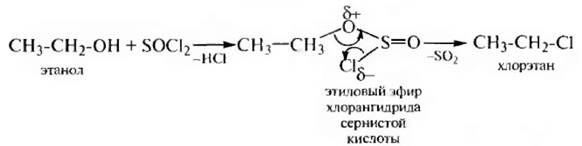
5. Взаимодействие с галогенангидридами неорганических кислот. Спирты взаимодействуют с галогенидами фосфора (РСl3, РСl5 и др.) и тионилхлоридом (SOCl2) с образованием галогеналканов:
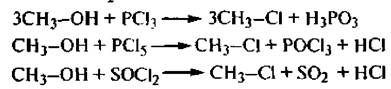
Реакция с тионилхлоридом SOCl2 протекает по механизму внутримолекулярного нуклеофильного замещения SNi:
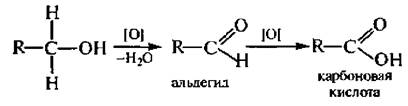
6. Окисление. Спирты окисляются под действием кислорода воздуха в присутствии катализаторов (Сu, СuО) и различных неорганических окислителей – оксида хрома (VI), хромовой смеси (дихромата калия в серной кислоте), перманганата калия в серной кислоте и др.
Первичные спирты образуют альдегиды (при дальнейшем окислении – карбоновые кислоты с тем же числом углеродных атомов).
Вторичные спирты окисляются до кетонов:
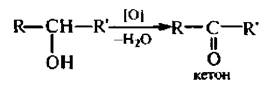
Третичные спирты более устойчивы к окислению. При действии сильных окислителей происходит расщепление углеродного скелета молекулы третичного спирта с образованием смеси карбоновых кислот и кетонов.
В промышленности спирты превращают в альдегиды или кетоны путем каталитического дегидрирования. При пропускании паров спирта нал катализатором (Zn. Си. Ag) при температуре 300 °С происходит отщепление водорода и образуются альдегиды или кетоны:
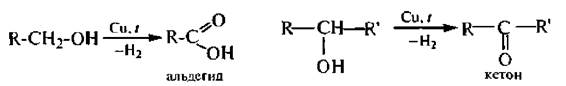
7. Взаимодействие с магнийорганическими соединениями. Спирты реагируют с реактивами Гриньяра. Атом водорода гидроксигруппы замещается на магнийгалоген и выделяется газообразный углеводород.
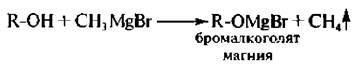
Измерив объем выделившегося газа, определяют количество гидроксильных групп в молекуле спирта (реакция Чугаева – Церевитинова).