
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакции по ароматическому ядру
|
|
Гицроксильная группа является одним из самых сил ьных доноров электронов (+М), она значительно повышает электронную плотность в бензольном ядре и тем самым увеличивает его реакционную способность в реакциях SE.
1. Премирование. При взаимодействии фенола с бромной водой в отсутствии катализатора в молекулу вводится три атома брома и образуется 2, 4, 6-трибромфенол:
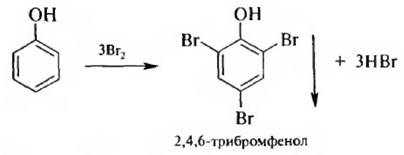
Эта реакция используется для качественного и количественного определения фенола.
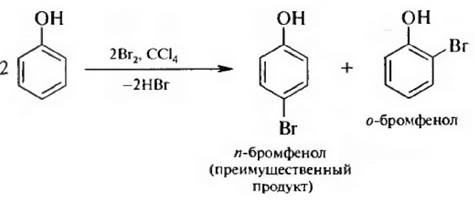
Для введения одного или двух атомов брома в бензольное кольцо реакцию бронирования проводят в низкополярных растворителях (CCl4, CHCl3)
2. Нитрование. Если бензол нитруется только нитрующей смесью, то фенол можно нитровать разбавленной азотной кислотой при комнатной температуре;
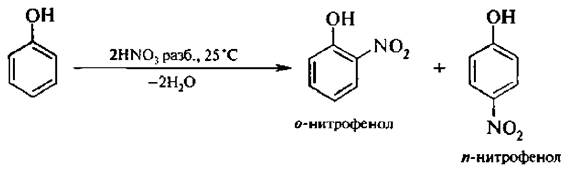
В этих условиях в молекулу фенола вводится одна нитрогруппа. Полученную смесь нитрофенолов можно разделить перегонкой с водяным паром. В связи с тем, что в молекуле о -нитрофенола гидроксильная и нитрогруппа находятся рядом, между атомом водорода ОН-группы и атомом кислорода NO2-группы образуется внутримолекулярная водородная связь (ВВС):
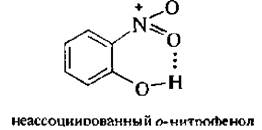
Подобные соединения легколетучи. Как видно, образуется 6-членный цикл за счет хелатной водородной связи (внутримолекулярная водородная связь называется хелатной).
Молекулы папа -изомера образуют межмолекулярные водородные связи (МВС):

Для п - и о -нитрофенолов характерна бензоидно-хиноидная таутомерия. Мета -нитрофенолы не являются таутомерными веществами, так как в них нет сопряжения между ОН- и NO2-группами,

Свободные нитрофенол – бесцветные вещества или имеют желтую окраску. При добавлении щелочей образуются соли нитрофенолов, окрашенные в ярко-желтый цвет.
При действии концентрированной азотной кислоты на фенол образуется осадок 2, 4, 6-тринитрофенола:
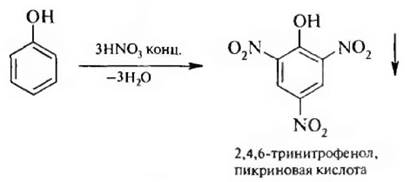
2, 4, 6-Тринитрофенол называется пикриновой кислотой, по кислотности он приближается к серной кислоте,
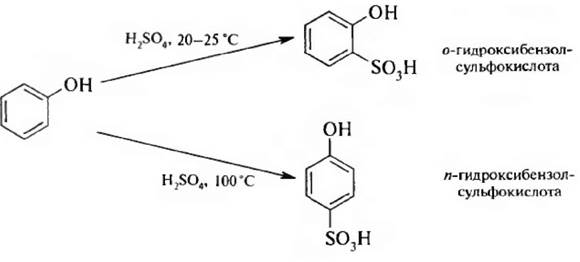
3. Сульфирование. Сульфирование фенола проходит очень легко и в зависимости от температуры приводит к о- или п -изомерам:
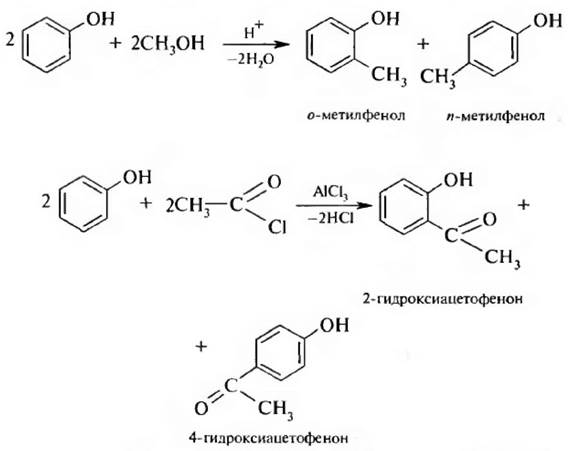
4. Алкилирование и ацилирование. Реакции алкилирования и ацилирования по бензольному кольцу (С-алкилирование и С-ацилирование фенолов) проводят в условиях реакции Фриделя – Крафтса;
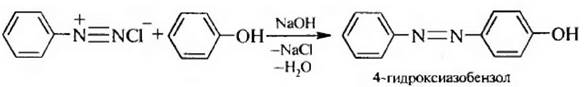
5. Азосочетание. Фенолы в качестве азосоставляющей в слабощелочной среде вступают в реакцию азосочетания с солями диазония с образованием азосоединений:
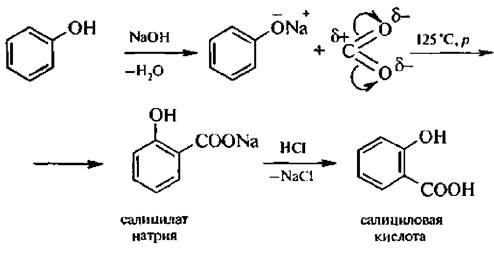
6. Синтез фенолкарбоновых кислот (реакция Кольбе – Шмитта). При пропускании углекислого газа через раствор фенолята натрия образуется салицилат натрия, который при действии минеральных кислот образует салициловую кислоту.
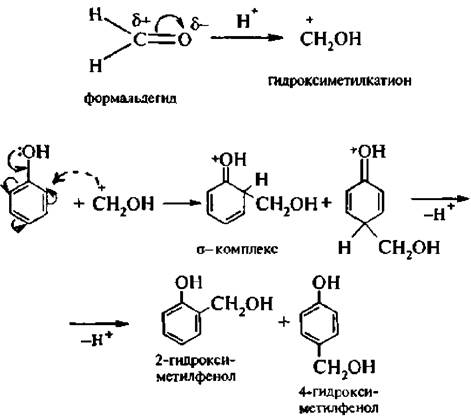
7. Гидроксиметилирование. При обработке фенолов формальдегидом в кислой или щелочной среде образуется смесь о- и п- гидрокси-метилфенолов. Реакция протекает по механизму SE, электрофильной частицей в условиях кислотного катализа является гид рокси метилкатион +СН2ОН:
В присутствии минеральных кислот гидроксиметилфенол вступает в реакцию конденсации с молекулой фенола:
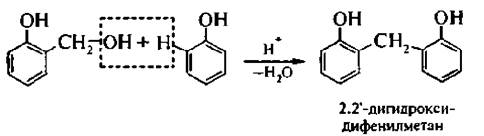
В более жестких условиях образуются высокомолекулярные продукты поликонденсации – фенолоформальдегидные смолы.

В результате такой реакции поликонденсации могут образовываться смолы линейного или сетчатого строения.