
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
РН буферных растворов.
|
|
Для буферной системы I типа НА/A- концентрацию ионов Н+ в растворе легко вычислить, исходя из константы диссоциации слабой кислоты (для простоты изложения вместо активностей ионов в выражении для 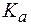 будем использовать их концентрации):
будем использовать их концентрации):
НA ⇄ A- + H+;
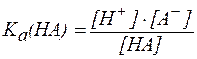 , ,
|
отсюда:
 . .
|
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу Ле Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A- равна концентрации соли.
В таком случае можно записать:
 , ,
| (3) |
где С(кислоты) и С(соли) – молярные концентрации кислоты и соли.
Если равенство (3) прологарифмировать (взять отрицательный десятичный логарифм левой и правой частей уравнения), то получим:
 . .
| (4) |
Так, рН фосфатной буферной системы состава NaH2PO4/Na2HPO4 можно рассчитать по уравнению:
 , ,
|
где 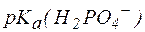 – показатель константы диссоциации фосфорной кислоты по второй ступени.
– показатель константы диссоциации фосфорной кислоты по второй ступени.
В случаях, когда требуется получить буферный раствор с задан-ным значением pH, используют уравнение:
 , ,
| (5) |
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН+, например аммонийной, гидроксидный и водородный показатели вычисляют по уравнениям:
 , ,
| (6) |
 , ,
| (6¢) |
где 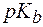 – показатель константы диссоциации основания.
– показатель константы диссоциации основания.
В общем виде уравнение для расчета pH буферных систем выглядит следующим образом:
 , ,
| (7) |
и называется уравнением Гендерсона-Гассельбаха.
Из уравнения Гендерсона-Гассельбаха следует, что:
1. Величина рН буферных растворов зависит от константы диссоциации кислоты или основания и от соотношения количеств компонентов, но практически не зависит от разбавления или концент-рирования растворов. Действительно, в этих процессах концентрации компонентов буферного раствора изменяются пропорционально, поэтому их соотношение, которое определяет значение рН буферного раствора, остается неизменным.
Если концентрации компонентов буферных растворов превы-шают 0, 1 моль/л, то в расчетах необходимо учитывать коэффициенты активности ионов системы.
2. Показатель константы диссоциации слабого электролита опре-деляет область буферного действия раствора, т.е. тот интервал значе-ний водородного показателя, в котором сохраняются буферные свой-ства системы. Поскольку буферное действие продолжается, пока не израсходовано 90% компонента (т.е. его концентрация не уменьши-лась на порядок), то область (зона) буферного действия отличается от  на 1 единицу:
на 1 единицу:
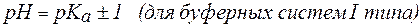 ;
;
 .
.
Амфолиты могут иметь несколько зон буферного действия, каждая из которых отвечает соответствующей константе  :
:
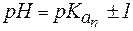 .
.
Таким образом, максимально допустимое соотношение компонентов раствора, при котором он проявляет буферное действие, составляет 10: 1.
Пример 1. Можно ли приготовить ацетатный буфер с рН = 6, 5, если  уксусной кислоты равен 4, 74?
уксусной кислоты равен 4, 74?
Решение.
Поскольку зона буферного действия определяется как  , для ацетатного буфера она находится в интервале значений рН от 3, 74 до 5, 74. Значение рН = 6, 5 лежит за пределами зоны действия ацетатного буфера, поэтому на основе ацетатной буферной системы такой буфер приготовить нельзя.
, для ацетатного буфера она находится в интервале значений рН от 3, 74 до 5, 74. Значение рН = 6, 5 лежит за пределами зоны действия ацетатного буфера, поэтому на основе ацетатной буферной системы такой буфер приготовить нельзя.