
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Зависимость константы равновесия от температуры. Изобара химической реакции
|
|
Резкое возрастание скорости (константы скорости) химических реакций при повышении температуры очевидно и объяснимо за счет резкого увеличения числа активных соударений. Для обратимых реакций следует учитывать, что скорости прямой и обратной реакции тоже возрастают при повышении Т. При этом константа равновесия Kp = 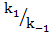 может оказаться как убывающей, так и возрастающей функцией температуры, в зависимости от того, какая константа возрастает сильнее. Как следует из уравнения Аррениуса (6.7.3), температурная зависимость константы скорости определяется величиной энергии активации: чем она больше тем сильнее эта зависимость, из этого следует, что для эндотермических реакций (энергия активации больше экзотермической на величину Δ Н). Поэтому для эндотермических и экзотермических (прямых) реакций константа равновесия должна по разному зависеть от темепературы. Эту температурную зависимость определяют уравнения изобары и изохоры химических реакций. Первая – при протекании реакции при Р=const., вторая при V= const.
может оказаться как убывающей, так и возрастающей функцией температуры, в зависимости от того, какая константа возрастает сильнее. Как следует из уравнения Аррениуса (6.7.3), температурная зависимость константы скорости определяется величиной энергии активации: чем она больше тем сильнее эта зависимость, из этого следует, что для эндотермических реакций (энергия активации больше экзотермической на величину Δ Н). Поэтому для эндотермических и экзотермических (прямых) реакций константа равновесия должна по разному зависеть от темепературы. Эту температурную зависимость определяют уравнения изобары и изохоры химических реакций. Первая – при протекании реакции при Р=const., вторая при V= const.
Изобару химической реакции в дифференциальной форме можно записать так:
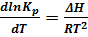 (6.14),
(6.14),
а изохору:
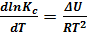 (6.15)
(6.15)
Решая эти уравнения при допущении, что тепловые эффекты реакций не изменяются в небольшом температурном интервале, получаем для изобары:
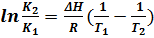 (6.16),
(6.16),
для изохоры:
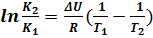 (6.17)
(6.17)
Соотношения 6.14- 6.17 показывают, что температурная зависимость константы скорости определяется знаком Δ Н или Δ U, так при экзотермической реакции (Δ Н< 0), константа равновесия при повышении температуры будет убывать, и наоборот для эндотермической (Δ Н> 0) возрастать, что и объясняет принцип Ле- Шателье.
Выводы:
1. Все химические превращения по разному протекают во времени.
2. Большинство процессов обратимы.
2.1. В определенных условиях можно рассматривать реакцию как одностороннюю.
3. Скорость процессов зависит от внутренних и внешних факторов.
3.1. Внутренние – природа реагирующих веществ (определяется энергией активации).
3.2. Внешние:
- температура;
- концентрация;
- давление.
4. Изменяя условия, можно регулировать скорость процесса.
5. Для обратимых реакций положение равновесия определяется внешними условиями и описывается константой равновесия.
6. Положение равновесия можно смещать, изменяя эти условия.
Контрольная работа №2.1
1. Химимические реакции бывают: ___________________________________
2. Скорость реакции ____________
3. Зависимость скорости реакции от концентрации _____________________
4. Порядок реакции это ___________. Эксперименитальное определение порядка.
5. Кинетическое уравнение реакции 2-го порядка: ___________. Определение константы скорости ______________________.