
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Первый закон термодинамики
|
|
Задачи 370-394 [1]
| № п/п | Уравнение реакции | № п/п | Уравнение реакции |
| 4HCl(г)+O2(г) = 2H2O(г)+ 2Cl2(г) | 2CO2(г) = 2CO(г) + O2(г) | ||
| CH4(г)+ 2O2(г) = CO2(г)+ 2H2O(ж) | Fe2O3(к) + CO(г) = 2FeO(к) + CO2(г) | ||
| Fe3O4(к)+ 4CO(г)= 3Fe(к)+ 4CO2(г) | PbO(к) + CO(г) = Pb(к) + CO2(г) | ||
| 3Fe3O4(к) + 8Al(к) = 4Al2O3(к) + 9Fe(к) | C2H4(г) + H2O(г) = C2H6O(г) | ||
| 3H2O(г) + 2Al(к) = Al2O3(к) + 3H2(г) | FeO(к) + Mn(к) = MnO(к) + Fe(к) | ||
| Fe3O4(к) + 4H2(г) = 3Fe(к) + 4H2O(г) | 2FeO(к) + Si(к) = 2Fe(к) + SiO2(к) | ||
| S(к)+ 2N2O(г) = SO2(г) + 2N2(г) | FeO + C = Fe + CO | ||
| H2S(г) + Cl2(г) = 2HCl(г) + S(к) | 3Fe2O3(к) + H2(г) = 2Fe3O4(к) + H2O(г) | ||
| CO(г) + H2O(г) = CO2(г) + H2(г) | GeO2(к) + 2Cl2(г) + 2C(к) = GeCl4(г) + 2CO(г) | ||
| Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г) | CH4(г) + H2O(г) = CO(г) + 3H2(г) | ||
| 2PbS(к) + 3O2(г) = 2PbO(к) + 2SO2(г) | WO3(г) + 3H2(г) = W(к) + 3H2O(г) | ||
| CaCO3(к) = CaO(к) + CO2(г) | 2MoO2(к) + 6CO(г) = Mo2C(к) + 5CO2(г) | ||
| Fe(к)+ H2O(г)= FeO(к)+ H2(г) |
В задачах 370-394 определите стандартный тепловой эффект реакции при:
а) изобарном её проведении ∆ rH0298;
б) изохорном её проведении - ∆ r U0298
(стандартные значения термодинамических функций приведены в приложении - см. стр.44 – Приложение «Термодинамические свойства веществ»).
Алгоритм выполнения заданий:
1. Выписываем условие задания:
2. Внимательно читаем условие задания.
3. Выписываем ключевые слова, незнакомые слова, непонятные слова – уясняем значение, составляем глоссарий.
4. Изучаем теоретические положения, необходимые для выполнения задания.
5. Уясняем условие задачи.
6. Составляем алгоритм выполнения задачи.
7. Выполняем задачу:
Пример выполнения задания:
| Fe(тв)+ H2O(г)= FeO(тв)+ H2(г) |
1. Выписываем условие задания:
В задаче 382 определите стандартный тепловой эффект реакции при:
а) изобарном её проведении ∆ rH0298;
б) изохорном её проведении - ∆ r U0298
(стандартные значения термодинамических функций приведены в приложении - см. стр.44 – Приложение «Термодинамические свойства веществ»).
2. Внимательно читаем условие задания.
3. Выписываем ключевые слова:
Ключевые слова:
Тепловой эффект химической реакции реакции – – количество теплоты, выделившейся либо поглотившейся в ходе реакции.
Тепловой эффект относят, как правило, к числу молей прореагировавшего исходного вещества, стехиометрический коэффициент перед которым максимален.
Например, реакцию окисления водорода в химической термодинамике записывают в виде:
Н2 + 1/2 О2 ––> Н2О
и тепловой эффект рассчитывают на 1 моль водорода.
Тепловой эффект определяется при условии, что система не совершает никакой работы (кроме возможной работы расширения), а температуры реагентов и продуктов равны.
Стандартный тепловой эффект реакции: это тепловой эффект реакции, осуществляемой в условиях, когда все участвующие в реакции вещества находятся в заданных стандартных состояниях.
Стандартное состояние характеризуется стандартными условиями: давлением p0, т-рой Т0, составом (молярная доля x0).
Комиссия ИЮПАК по термодинамике определила (1975) в качестве основного стандартного состояния для всех газообразных веществ чистое вещество (х0 = 1) в состоянии идеального газа сдавлением р0 = 1 атм (1, 01 · 105 Па) при любой фиксированной температуре.
Для твердых и жидких в-в основное стандартное состояние - это состояние чистого вещества (х0 = 1), находящегося под внешним давлением р0 = 1 атм. В определение стандартного состояния ИЮПАК Т0 не входит, хотя часто говорят о стандартной т-ре, равной 298, 15 К.
Если реакцию проводят при стандартных условиях при Т = 298, 15 К = 25 ˚ С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции Δ H rO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Изобарный процесс – когда реакция протекает при постоянном давлении Qp.
Изохорный процесс - когда реакция протекает при постоянном объёме Qv.
Термодинамические функции - (термодинамические потенциалы) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Выделяют следующие термодинамические потенциалы:
· Внутренняя энергия
· энтальпия
· Энтропия
· Энергия Гиббса (или потенциал Гиббса
· свободная энергия Гельмгольца
· большой термодинамический потенциал
Внутренняя энергия - (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекул. Определяется в соответствии с первым началом термодинамики, как разность между количеством теплоты, сообщенным системе, и работой, совершенной системой над внешними телами:
 .
.
Энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. 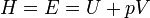
Энтропия - S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение общего количества тепла 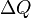 к величине абсолютной температуры
к величине абсолютной температуры 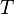 :
:
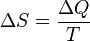 .
.

· Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции.
G=U+PV-TS
· Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности процесса является неравенство
· Δ G < 0
· Таким образом, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном. Увеличение энергии Гиббса
· Δ G > 0
· свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
· Если
· Δ G = 0
· то система находится в состоянии химического равновесия.
· Так как энергия Гиббса зависит от энтропии и энтальпии следующим образом:
· Δ G= Δ Н- TΔ S
· где Н - энтальпия, S - энтропия, Т - температура, то самопроизвольному протеканию процесса способствуют уменьшение энтальпии и увеличение энтропии системы.
· Если энтальпия и энтропия изменяются одновременно, то возможность процесса определяет либо энтальпийный, либо энтропийный фактор.
стандартные значения термодинамических функций
Термодинамические свойства веществ
4. Изучаем теоретический материал, необходимый для выполнения задания:
· Основные понятия и определения химической термодинамики,
· Первый закон термодинамики и его приложение к процессам в идеальном газе https://physics.kgsu.ru/index.php? id=163& option=com_content& view=article;
· Понятие теплового эффекта химической реакции;
· Стандартные энтальпии образования и сгорания веществ;
· Закон Гесса и следствия из него – первое следствие; второе следствие (Гуров и к0., Химия, стр.176- 190).
Теоретическая часть:
Закон Гесса— основной закон термохимии, который формулируется следующим образом:
· Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
Обобщенный химический процесс превращения исходных веществ А1, А2, А3... в продукты реакции В1, В2, В3 может быть осуществлен различными путями в одну или несколько стадий:
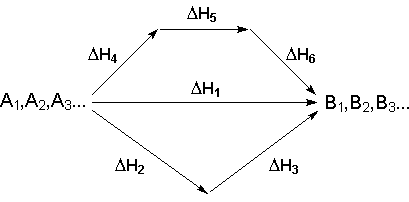
Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
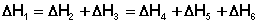
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты разнообразных химических процессов; для этого обычно используют ряд следствий из него:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
2.Тепловой эффект химической реакции равен разности сумм теплот образования (Δ Hf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
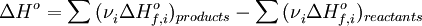
3.Тепловой эффект химической реакции равен разности сумм теплот сгорания (Δ Hc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):

Теплота образования вещества – тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования простых веществ принимаются равными нулю.
Теплота сгорания вещества – тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших устойчивых оксидов.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода
равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 74.9 кДж/моль.
Стандартная энтальпия образования обозначается Δ H fO. Здесь индекс f означает formation (образование), а кружок то, что величина относится к стандартному состоянию вещества.
В литературе часто встречается другое обозначение стандартной энтальпии — Δ H298, 150, где 0 указывает на равенство давления одной атмосфере (или, несколько более точно, на стандартные условия), а 298, 15 — температура.
Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество[4]. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе. Кружок в таком случае означает собственно стандартное состояние вещества, независимо от его выбора.
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии Δ H I2(тв)0 = 0 кДж/моль, а для жидкого йода Δ H I2(ж)0 = 22 кДж/моль.
Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту.
Табличные величины теплот образования и сгорания веществ обычно относятся к т. н.стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Физические постоянные величины
· Абсолютная температура точки плавления льда (0o С) 273.150 К.
Абсолютная температура тройной точки воды 273.160 К.
Молярный объём для идеального газа 22.414 л. моль-1 (при 273, 15К, 101325Па).
Постоянная Больцмана k = R / NA = 1.3806. 10-23 Дж. K-1.
Газовая постоянная
R = 8.314 Дж. K-1. моль-1
R = 1.987 кал. K-1. моль-1 = 82.057 см3. атм. К-1. моль-1
Элементарный заряд e = 1.602. 10-19 кулон
Число Авогадро NA = 6.0225. 1023 моль-1.
Число Фарадея F = 96493.5 кулон г-экв-1.
Переводные множители
· 1 Дж = 1 Н. м = 1 кг. м2. сек-2 = 0.239 кал = 107 эрг
1 атм = 101325 Па = 101325 Н. м-2 = 1.01325 бар = 760 мм рт. ст. 
1 бар = 105 Па
5. Уясняем условие задачи.
6. Составляем алгоритм выполнения задачи:
· Определяем стандартный тепловой эффект реакции изобарного процесса в соответствии с законом Гесса.
· Определяем стандартный тепловой эффект реакции изохорного процесса
7. Решаем задачу:
Решение.
Стандартный тепловой эффект реакции изобарного процесса в соответствии с законом Гесса определяется по уравнению:
Δ rH0298 = Δ fH0298(FeO(тв)) + Δ f H0298 (H2(г)) – (nΔ f H0298 (Feтв)) - Δ f H0298 (H2O)(г))=-
где Δ f H0 298 – стандартная энтальпия образования компонента, приведенная в приложении 1 (стр. 44):
Выписываем значения из таблицы:
Δ rH0298 (FeO(тв)) = - 264(кДж/моль);
Δ f H0298 (H2(г))=0, 0 (кДж/моль);
Δ f H0298 (Feтв))= 0, 0 (кДж/моль);
Δ f H0298 (H2O)(г)=-242 (кДж/моль);
Подставим данные и получим:
Δ rH0298 =(-264) +0, 0-0, 0 –(-242 (кДж/моль)=-22(кДж/моль); - Реакция экзотермическая, так как Δ rH0298 < 0;
Стандартный тепловой эффект изохорного процесса Δ rU0298 можно вычислить через стандартный тепловой эффект изобарного процесса по уравнению:
Δ rU0298 = Δ rH0298 – Δ ν RT, где Δ ν - изменение количества моль газов в реакции. Для данной реакции Δ ν =n(H2(г)) –n(H20(г)) =1-1 =0;
Подставим данные и получим:
Δ rU0298 = -2 2*103(Дж/моль) -0*8, 314*298=-2 2*103(Дж/моль)
В задачах 395-414 вычислите, сколько теплоты выделится при полном сгорании указанного количества вещества при стандартных условиях. Учтите, что в продуктах сгорания углерод находится в виде углекислого газа, водород – водяного пара, сера – сернистого газа, азот выделяется в свободном состоянии.
| № п/п |
| Количество вещества | № п/п | Вещество | Количество вещества | |||||||
| СH4 | 3 моль | С6H5NO2 | 2 моль | |||||||||
| C2H4 | 20 л | C5H5N | 10 моль | |||||||||
| C2H2 | 5м3 | CH4N2O | 3м3 | |||||||||
| C2H6 | 20моль | C10H8 | 50моль | |||||||||
| C3H8 | 5дм3 | CH40 | 4моль | |||||||||
| H2S | 8моль | C3H6O | 6м3 | |||||||||
| CS2 | 40л | C4H10 | 9моль | |||||||||
| C3H6 | 7моль | CH3COOH | 40моль | |||||||||
| C4H8 | 6м3 | C2H5OH | 5моль | |||||||||
| CH2) | 25л | CH4O | 80моль |
| C4H10 | 9моль |
Задача 411:
вычислите, сколько теплоты выделится при полном сгорании указанного количества вещества при стандартных условиях.
Учтите, что в продуктах сгорания углерод находится в виде углекислого газа, водород – водяного пара.
Дано:
C4H10 – бутан
ν =9 молей
О2 –кислород
Продукты реакции: СО2(г) и Н2О(г)
Напишем уравнение реакции:
С4Н10(г) +О2 = СО2 +Н2О(г)
Уравняем коэффициенты – очень важно!!!
2С4Н10(г) +13О2 = 8СО2 +10Н2О(г)
Для решения используем первое следствие Закона Гесса:

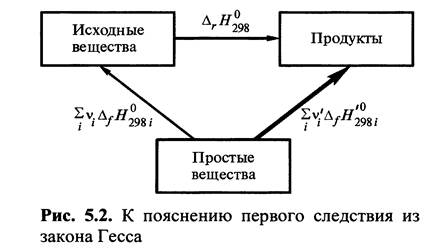
Выпишем из Приложения (стр.44) стандартные энтальпии образования компонентов реакции:
Δ f H0298 (С4Н10(г))=-126КДж/моль
Δ f H0298 (О2(г))=-0
Δ f H0298 (СО2(г))=-393 КДж/моль
Δ f H0298 (Н2О(г)))=-242КДж/моль
Δ f H0298= 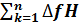 298*ν k-
298*ν k- 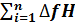 298i*ν i=[∆ fH298(CO2)(г))*8+[∆ fH298(Н2О(г))*10]- -[∆ fH298(C4Н10(г))*2+[∆ fH298(О2(г))*13] =[-393(КДж/моль)*8(моль)+(-242*10]-
298i*ν i=[∆ fH298(CO2)(г))*8+[∆ fH298(Н2О(г))*10]- -[∆ fH298(C4Н10(г))*2+[∆ fH298(О2(г))*13] =[-393(КДж/моль)*8(моль)+(-242*10]-
[-126*2+ 0*13]=(-768)+(-2420)-(-252+0)=-3206+252 =-2954< 0 – реакция экзотермическая
Δ f H0=∆ Ur+P∆ V; P∆ V = ν RT
Δ f H0=∆ Ur+P∆ V=∆ Ur+ ν RT;
Определяем изменение числа молей в реакции:
Только для газа!
∆ ν = 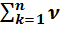 –
– 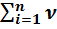 = [ν (CO2(г) +ν (Н2О)(г)] – [ν (C4H10)(г)+ν (О2)(г)]=[8+10]-[2+13]=18-15=3 – изменение на 3 моля
= [ν (CO2(г) +ν (Н2О)(г)] – [ν (C4H10)(г)+ν (О2)(г)]=[8+10]-[2+13]=18-15=3 – изменение на 3 моля
∆ Ur= Δ f H 0– ν RT = - 2954-3*8, 31*298 =-10383, 14;
На сколько изменился объем:
1 моль – 22, 4 л
3 моля – х л
Х=3*22, 4/1=67, 2