
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Калий-40
|
|
В 1807 г. английский химик Дэви электролизом твердого едкого кали (КОН) выделил калий и назвал его «потассий» (лат. Potassium, этоназвание до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 г. Л.В.Гильберт предложил название «калий» (лат. Kalium от арабского аль-кали – поташ).
Калий - элемент главной подгруппы первой группы четвёртого периода периодической системы химических элементов Д.И.Менделеева с атомным номером 19. Обозначается символом К – (лат. kalium). Простое вещество калий - мягкий щелочной металл серебристо-белого цвета. Очень лёгок и легкоплавок. В природе в свободном состоянии не встречается, а только в соединениях с другими элементами, например в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и легко вступает в химические реакции, особенно с водой, образуя щелочь.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. Растворимость едкого калия при 20°С в 100 г. воды составляет 112 г. Относительно хорошо растворяется в ртути, образуя амальгамы [4, 28].
Природный элемент калий состоит из трех изотопов: 39К (93, 98 %), 40К (0, 0119 %) и 41К (6, 91 %). Из них 40К является радиоактивным изотопом с периодом полураспада 1, 3·109 года. Радиоактивный распад проходит по схеме:

Радиоизотоп 40К составляет около 0, 012 % природного калия. Обычная питьевая вода содержит около 2, 5 ч. на 1 млн калия или 3 10 мг/л40К. Эта концентрация примерно эквивалентна 2 мкКюри/л или 2 10 мкКюри/мл.
Так как в природных условиях изотопный состав элементов не меняется, то всюду, где бы ни находился элемент калия, он всегда сопровождается своим радиоактивным изотопом 40К и, следовательно, постоянно излучает поток электронов и γ -кванты. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40К, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40К считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт).
В минералах, содержащих калий, постепенно накапливается 40Аг, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии. В качестве примера успехов, достигнутых с помощью калий-аргонового метода, рассматривают проведенную датировку инверсий магнитного поля Земли.
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей [4, 28].Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и химически активен, легко отдаёт электроны. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия КО2 (или К2О). Является сильным восстановителем. Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления -78°С. Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока. Перхлорат и хлорат (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике. Перманганат калия — сильный окислитель и используется как антисептическое средство в медицине и для лабораторного получения кислорода, тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика, а дигидрофосфат и дидейтерофосфат – в виде монокристаллов в лазерной технике.
Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислой газ с выделением кислорода). Фтороборат калия — важный флюс для пайки сталей и цветных металлов. Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. Бихромат (хромпик) – сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина. Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород(калиевый цикл «Газ де Франс», Франция).
Калий является неотъемлемым элементом живых организмов. Хотя 40К может составлять от 5 до 50 % природной β -активности питьевой воды, содержание этого изотопа в воде не считается опасным для здоровья. Проникнув в организм человека, 40К отчасти концентрируется в половых клетках, но в силу своей низкой удельной активности и небольшой концентрации в воде он не относится к опасным радиоизотопам. Из окружающей природной среды (ОПС) он поступает в основном в виде хлористых и углекислых солей, распределяется по всему живому организму и присутствует в любой его ткани, клетке, субклеточных органеллах. Его содержание регулируется специальными физиологическими системами. Калий принимает участие в ряде биохимических и биофизических процессов.
Калий-40 является основным радионуклидом, обусловливающим постоянное внутреннее γ - и β -облучение живых тел. Живые организмы, постоянно поглощая калий из ОПС, накапливают в себе значительные количества 40К. Так, например, его содержание в морских микроорганизмах – 330-600 Бк/кг, водорослях – 570-800, в мышцах морских организмов – 57-216 Бк/кг сухого веса при его содержании в морской воде 12-15 Бк/кг. Из почвы 40К поступает через корневую систему в растения и с растительной пищей – в организмы животных. В табл.9 представлено содержание 40К в растениях [7, 8, 12].
Таблица 9
Содержание калия-40 в растениях, употребляемых в пищу, Бк/кг
| Вид растений | Содержание 40К в свежей ткани |
| Зерновые | 18, 5-159 |
| Зернобобовые | 177-299 |
| Овощи свежие | 40-174 |
| Плоды свежие | 7, 4-335 |
| Грибы |
Примечание. Особо богаты 40К: фасоль – 299, картофель – 174, орехи – 210, клюква – 355 Бк/кг.
Калий - важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются плохо, уменьшается урожай. Поэтому около 90% добываемых солей калия используются в качестве удобрений.
Для различных полевых растений концентрация калия варьирует в десятки раз, повышаясь у высших цветковых растений, снижаясь у голосемянных и имея низшие значения у мхов и лишайников. У высших растений доля участия 40К в общей β -активности золы может достигать 50-60 %. С растительной пищей 40К поступает в организм животных и человека. Его распределение по тканям человеческого организма показано в табл. 10.
Калий содержится большей частью в клетках, до 40 раз больше, чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции: создание условий для возникновения мембранного потенциала и мышечных сокращений; поддержание осмотической концентрации крови и кислотно-щелочного баланса; нормализация водного баланса; обеспечение мембранного транспорта; активация многих ферментов; нормализация ритмов сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 мг, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных средств повышают потребность организма в калии.
Усвоение калия облегчает витамин В6, затрудняет — алкоголь. При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии. При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Калий-40 входит в состав многих земных пород, минералов и почв и вносит свой вклад во внешнее облучение биоты. Значение 40К как внешнего облучателя особенно велико для обитателей почвы – микрофлоры, корней растений, почвенной фауны, на которые воздействуют излучения при непосредственном соприкосновении с излучателем. Во внешнем облучении наземных растений и животных основное место принадлежит γ -квантам 40К [4, 9, 26, 28].
Таблица 10
Концентрация калия-40 в тканях человеческого организма
| Название ткани | Средняя концентрация, г/кг ткани | Концентрация активности, Бк/кг ткани |
| Тимус | 0, 6 | |
| Кожа | 0, 8 | |
| Щитовидная железа | 1, 2 | |
| Кишечник | 1, 2 | |
| Тонкий кишечник | 1, 3 | |
| Кровь | 1, 6 | |
| Легкие | 1, 9 | |
| Семенники | 2, 0 | |
| Сердце | 2, 1 | |
| Печень | 2, 5 | |
| Центральная нервная система | 2, 9 | |
| Головной мозг | 3, 0 | |
| Мышцы скелета | 3, 0 | |
| Селезенка | 3, 1 | |
| Эритроциты | 3, 4 | |
| Красный костный мозг | 4, 0 |
Близкий по своим химическим свойствам калию рубидий и его радиоизотоп рубидий-87 (87Rb) распространены в ОПС в микроколичествах. Это долгоживущий радиоизотоп (период полураспада 6, 1·1010 лет) с мягкими β -излучением (0, 275 МэВ) и γ -излучением (0, 94 МэВ). Его концентрация в тканях живых организмов составляет в среднем 8, 5 Бк/кг. Вклад в общее постоянное облучение биоты незначителен.
4. Изотопы радия
Радий — элемент главной подгруппы второй группы, седьмого периода Периодической системы химических элементов Д.И.Менделеева с атомным номером 88. Обозначается символом Ra. Слово radium (радий) происходит от латинского radius - «луч», дословно название этого элемента переводится как «излучающий», «лучистый». Простое вещество радий - блестящий щелочно-земельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчивый изотоп Ra. Получить чистый радий в начале ХХ века стоило огромного труда. На каждые три миллиона атомов урана в природе приходится лишь 1 атом радия [2-5].
Радий добывают из урановых руд и радиевых вод. Впервые этот элемент был выделен Марией и Пьером Кюри в 1898 г. из урановой смолки Яхимовского месторождения (Чехия). Радий довольно редок. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1, 5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0, 0001 г радия-226. Поэтому на начало ХХ века в мире не было более дорогого металла. За 1 г радия нужно было заплатить более 200 кг золота. За открытие радия и полония супруги Кюри получили Нобелевскую премию. Из Яхимовских урановых руд до 1931 г. извлекли 39 г радия. Уже в ходе этой самой первой работы стало ясно, что новый элемент – аналог бария: при фракционном разделении компонентов активность накапливалась в бариевой фракции.
В нашей стране радий впервые был извлечен из урановой руды в 1921 г. В.Г.Хлопиным. Эта руда добывалась в труднодоступных горах Средней Азии в очень малых количествах. Общие запасы урана не превышали 120 т, и из них можно было извлечь около 40 г радия.
Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде (см. рис. 1, 2). Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А (218Ро), радий В (Pb), радий С (Bi), радий D (Pb), радий Е (Bi), радий F (Po), радий С (Ро), радий С (Tl). Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются.
Названная в часть Кюри внесистемная единица радиоактивности Кюри основана на активности 1 г радия-226: 3, 7∙ 10 распадов в секунду, или 37 ГБк.
Радий-226 (α - и γ -излучатель) сопутствует урану в местах его накопления, а в мелкодисперсном состоянии повсеместно распространен в земных породах, почвах, воде различного происхождения. О его содержании в ОПС дает представление табл. 11 [НКДАР, 1962].
Радий 226Ra – α - и γ -радиоактивный изотоп с периодом полураспада 1617 лет. Распад радия сопровождается образованием радона, а также мощным α - и γ -излучением [7, 8, 29]. γ -излучение опасно на значительных расстояниях, α -излучение опасно при попадании внутрь организма (табл. 12). Точечный источник в 1 мг радия в равновесии с ДПР на расстоянии 1 см (при наличии платинового фильтра толщиной 0, 5 мм) создает мощность экспозиционной дозы γ -излучения (МЭД ГИ) 8, 4 Р/ч. Используется в технических и эталонных источниках γ -излучения.
Соли радия обладают свойством светиться в темноте. По этой причине наиболее широкое применение радий нашел в оборонных отраслях промышленности, в частности, в судостроении и авиастроении, в составе светящихся красителей – светомассы постоянного действия (СПД). СПД в 40 – 60-х годах наносился на циферблаты часов, елочные украшения.
В медицине радий используется для радиотерапевтических целей.
Велись исследовательские работы по использованию радия (наряду с ураном и радиоактивными сланцами) в составе микроудобрений.
Изотопы радия (226Ra, 228Ra, 224Ra), наряду с изотопами урана, являются наиболее распространёнными среди ЕРН в природных водах, и отличаются высокой радиотоксичностью; ограничения объемной активности (ОА) в питьевой воде для них – одни из наиболее жестких. Соответствующие уровни вмешательства (УВвода) характеризуются низкими значениями, особенно для 228Ra и 226Ra.
Фоновые значения УА 226Ra в горных породах и почвах составляют от 5 до 50 Бк/кг, в то время как ОА в подземных водах могут варьировать в очень широком диапазоне (табл.11).
Таблица 11
Содержание радия-226 в различных средах
| В горных породах, Бк/кг | |
| Граниты | 96-114 |
| Базальты | 18, 5-40, 7 |
| Песчаник | 11, 1-25, 9 |
| Известняк | 14, 8-25, 9 |
| Сланцы | 14, 8 |
| Алюминиевые сланцы (Швеция) | |
| В строительных материалах, Бк/кг | |
| Кирпич | 23-152 |
| Известковый кирпич | 6-25 |
| Бетон | 11-80 |
| Цемент | 9-168 |
| Газобетон на основе квасцовых глинистых сланцев | 320-2620 |
| Черепица | 63-91 |
| Дерево | 0, 3-0, 5 |
| Почвы | 3, 3-29, 6 |
| В воде, Бк/л | |
| Реки | 1, 85•10-4-2, 96•10-2 |
| Источники | 2, 59•10-3-5, 1 |
| Океаны | 7, 4•10-4-1, 1•10-2 |
| Водопроводная вода в разных городах | 3, 7•10-3-0, 38 |
Гидробионты морей и океанов накапливают радий из воды с различной интенсивностью [30]. Так, коэффициент накопления для камбалы равен 6, для мидий – 69, для моллюсков возрастает до 210.
Из почв и воды радий поступает в растения, где его содержание колеблется в пределах 2, 1·10-2-2, 5 Бк/кг. По пищевым цепям радий проникает в организмы рыб
(2, 5·10-2-23·10-2 Бк/кг), в мясо животных (1, 6·10-2-5·10-2 Бк/кг). С растительной и животной пищей радий поступает в организм человека [9, 26, 29-31].
Таблица 12
Основные характеристики изотопов радия
| Изотоп | Основной вид излучения | Период полураспада T1/2 | Значение УВвода, Бк/дм3 | Природные вариации ОА в водах (min – max), Бк/дм3 |
| 226Rа | α (Еα = 4780 кэВ); γ | 1617 лет | 0, 50 (НРБ-99) | n·10-2-n·102 |
| 228Rа | β (Еβ max = 55 кэВ) | 5, 75 лет | 0, 20 (НРБ-99) | n·10-2-n·102 |
| 224Rа | α (Еα = 5680 кэВ) | 3, 64 сут | 2, 10 (НРБ-99) | n·10-2-n·102 |
| 223Rа | α (Еα = 5710 кэВ); γ | 11, 43 сут | 1, 40 (НРБ-99) | n·10-3-n·10 |
Радий принадлежит к разряду остеотропных РВ, то есть веществ, отличающихся наибольшей токсичностью из-за их свойства накапливаться в костной ткани (около 70-90 %), которая обладает высокой радиочувствительностью, следствием чего являются лейкозы, лучевые остеосаркомы. Кроме того, радий накапливается в легких и печени [23]. Данные о присутствии и распределении радия в организме человека приведены в табл.13. Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения еще не была осознана.
Таблица 13
Поступление и распределение радия в организме человека
| Поступление с пищей в районах, Бк/сут | |
| • с нормальным радиационным фоном | (1, 48-6, 3)•10-2 |
| • с повышенным радиационным фоном | > 12, 2•10-2 |
| Концентрация, Бк/кг | |
| • в костях | 7, 4•10-2-2, 8 |
| • в мягких тканях | 2, 7•10-3 |
| Общее содержание в теле, Бк | 0, 55-51, 8 |
Изучение и использование радиоактивных свойств радия сыграло огромную роль в исследовании строения атомного ядра и явления радиоактивности. Химические методы, разработанные при выделении из руд соединений Ra и изучении их свойств, легли в основу методов радиохимии [5].
-спектрометрическим методами [31].(α -или γ " Известные методики определения изотопов радия в природных водах, отличающиеся способами измерения активности, включают стадию предварительного концентрирования. Коллекторами обычно служат труднорастворимые соли: карбонат кальция, сульфаты бария и свинца или двуокись марганца. Активность сконцентрированных в небольшом объеме изотопов радия определяют эманационным, радиометрическим,
Последнее большое событие в истории элемента №88 произошло в 1967 г. Практически одновременно в знаменитых лабораториях Дубны и Беркли были получены нейтроно-дефицитные изотопы радия с массовыми числами от 206 до 214. До этого времени были известны лишь изотопы с массовыми числами 213 и от 218 до 230. Все эти изотопы оказались короткоживущими альфа-излучателями с периодами полураспада от 0, 4 до 15 сек.
Большую опасность представляет радон 222Rn – газообразный радиоактивный продукт распада радия [60].Из 1 г радия образуется 1 мм3 222Rn в сутки. (рис. 4)
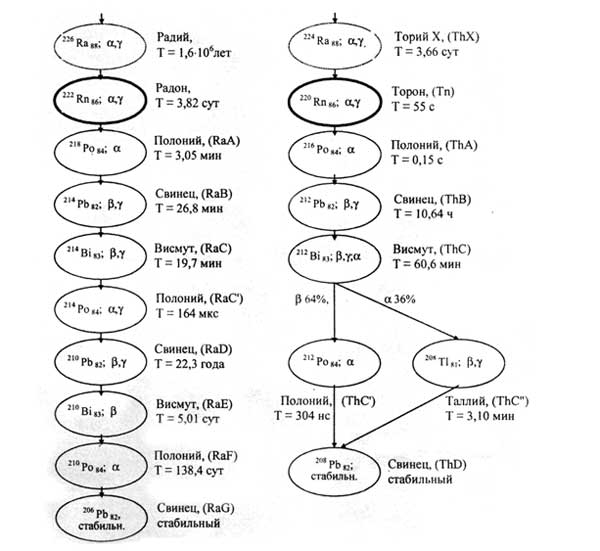
Рис. 4. Изотопы радона и их дочерние продукты в цепочках распада (символ, путь распада (α -, β -, γ -излучения), наименование, период полураспада Т).
По данным Научного Комитета по действию атомной радиации (НКДАР) при ООН, радон вместе со всеми дочерними продуктами распада (ДПР) ответственен примерно за 3/4 годовой индивидуальной эффективной дозы облучения, получаемой населением от земных источников радиации, и примерно за половину этой дозы от всех естественных источников радиации [15, 16, 29, 60].
5. Полоний
Полоний – первый после урана и тория открытый радиоактивный химический элемент, вписанный в VI группу Периодический системы элементов, аналог теллура. Атомный номер 84. Не имеет стабильных изотопов. Существование элемента с порядковым номером 84 было предсказано Д.И.Менделеевым, в 1889 г. он назвал его двителлуром (второй теллур) и предположил, что его атомная масса близка к 212.
Полоний в свободном виде – мягкий серебристо-белый радиоактивный металл, существует в двух модификациях [2 – 5, 11]. Из-за сильной радиоактивности светится в темноте и сильно нагревается, поэтому нужен непрерывный отвод тепла. Температура плавления полония 254°С (чуть выше, чем у олова), температура кипения 962°С, поэтому уже при небольшом нагревании полоний возгоняется. Плотность полония почти такая же, как у меди – 9, 4 г/см. На воздухе полоний медленно окисляется (быстро при нагревании до 250°С) с образованием красного диоксида (при охлаждении он становится желтым в результате перестройки кристаллической решетки).
Полоний был открыт в 1898 г. Пьером Кюри и Марией Склодовской-Кюри путем выделения из смоляной обманки (урановой руды). Он был назван в честь родины Марии Кюри – Польши (Polonia, лат.). На начало 2006 г. было известно 33 изотопа полония в диапазоне массовых чисел от 188 до 220. Кроме того, известны 10 метастабильных возбужденных состояний изотопов полония. Наиболее долгоживущий изотоп 209Po имеет период полураспада 102 года, однако его получение в чистом виде сложно, поэтому для практических целей применяют 210Ро (α -радиоактивен). Изотопы с массовыми числами 210-218 входят в природные радиоактивные ряды урана, тория и актиния (см. рис. 4); наиболее устойчивый из них – 210Po (период полураспада 138, 376 сут.). Он является членом уранового семейства и появляется в природной смеси в результате ряда последовательных превращений изотопов тяжелых элементов, первый из которых – 238U (табл. 14) [2, 32 - 34].
Таблица 14
Основные продукты распада радия-226 и их характеристика
| Нуклид | Название | Период полураспада | Природа излучения | Энергия, МэВ |
| 226Ra | Радий-226 | 1602 года | α | 4, 78 |
| γ | 0, 18 | |||
| 222Rn | Радон-222 | 3, 82 сут | α | 5, 49 |
| γ | 0, 51 | |||
| 218Po | Полоний-218 | 3, 05 мин | α | 6, 00 |
| β | 0, 72 | |||
| 214Pb | Свинец-214 | 26, 8 мин | α | 0, 35 |
| 214Bi | Висмут-214 | 19, 7 мин | α | 5, 45 |
| β | 1, 51 | |||
| γ | 0, 6-1, 7 | |||
| 210Tl | Таллий-210 | 1, 3 мин | β | 1, 9-2, 3 |
| γ | 0, 79 | |||
| 210Pb | Свинец-210 | 22, 3 года | β | 0, 01 |
| γ | 0, 04 | |||
| 210Po | Полоний-210 | 138.4 сут | α | 5, 3 |
| 210Bi | Висмут-210 | 5, 01 сут | β | 11, 1 |
| 206Tl | Талий-206 | 4, 2 мин | β | 1, 53 |
| 206Pb | Свинец-206 | стабильный | - | - |
Содержание в земной коре 210Po составляет всего 2•10-14 %; в одной тонне природного урана содержится 0, 34 г радия и доли миллиграмма 210Po. Самый короткоживущий из известных изотопов полония - 213Po (период полураспада 3•10-7 сут.). Самые легкие изотопы полония – чистые α –излучатели, более тяжелые одновременно испускают α - и γ -лучи. Некоторые изотопы распадаются путем электронного захвата, а самые тяжелые проявляют также очень слабую β -активность.
На практике в граммовых количествах 210Po синтезируют искусственно, облучая металлический висмут 209Bi нейтронами в ядерных реакторах. Если тот же изотоп висмута поместить в циклотрон и там обстрелять потоками протонов, то образуется самый долгоживущий изотоп полония 209Po. Микроколичества полония извлекают из отходов переработки урановых руд. Выделяют полоний экстракцией, ионным обменом, хроматографией и возгонкой. Металлический Po получают термическим разложением в вакууме сульфида PoS или диоксида (PoO2)x при 500°C.
С водородом полоний образует летучее соединение. Металлический полоний и его соединения сильно токсичны. Полоний-210 испускает α -лучи с энергией 5, 3 МэВ, которые в твердом веществе тормозятся, проходя всего тысячные доли мм и отдавая при этом свою энергию. Полоний удобно применять для исследования воздействия α -излучения на различные вещества [2-5]. 210Ро применяют в ампульных источниках нейтронов и как источник энергии в атомных батарейках.
Полоний-210 в сплавах с бериллием и бором применяется для изготовления компактных и очень мощных нейтронных источников, практически не создающих γ -излучения. Такие нейтронные источники легки и портативны, совершенно безопасны в работе и очень надежны. Например, латунная ампула диаметром 2 и высотой 4 см ежесекундно дает до 90 млн нейтронов. Отдельной областью применения полония является его использование в виде сплавов со свинцом или самостоятельно для производства мощных и весьма компактных источников тепла для автономных установок (1 см3 210Po выделяет 1320 Вт тепла). Время его жизни позволяет использовать полоний как источник энергии в атомных батареях космических кораблей (для получения мощности 1 кВт достаточно всего 7, 5 г полония). В этом отношении он превосходит другие компактные «атомные» источники энергии. Например, у советского лунохода для обогрева приборного отсека во время долгой лунной ночи применялся полониевый обогреватель.
Полоний встречается в природе, накапливается растениями, в том числе – табаком. 20 % полония-210, содержащихся в табаке сигарет, попадает в легкие человека. Среднее годовое поступление 210Po в легкие человека, выкуривающего одну пачку сигарет в сутки, составляет 60 мБк. О поступлении и содержании210Ро в теле человека можно судить по данным табл. 15.
Таблица 15
Содержание 210Pb и 210 Po в организме человека
| Показатели | 210Pb | 210Po |
| При нормальном содержании в пище: | ||
| Поступление с пищей, Бк-2/сут | 5, 18-22, 9 | 4, 8-17, 0 |
| Содержание у некурящих, Бк/кг | ||
| Костная ткань | 2, 4 | |
| Мягкая ткань | 0, 14-0, 2 | 0, 1-0, 2 |
| Содержание у курящих, Бк/кг | ||
| Костная ткань | 4, 81 | 3, 7 |
| Мягкая ткань | 0, 22-0, 33 | 0, 18-0, 33 |
| При высоком содержании в пище: | ||
| Поступление с морскими продуктами, Бк-2/сут | 62, 9 | |
| Поступление с мясом карибу и северных оленей, Бк-2/сут | 13, 3-162 | 222-1272 |
| Содержание Бк/кг | ||
| Костная ткань | 9, 25 | 7, 4 |
| Мягкая ткань | 0, 44-0, 55 | 1, 33-2, 66 |
Основным источником полония-210 в ОПСявляется радон-222, выделяющийся из почвы. Полоний-210 является также и техногенным изотопом. В период ядерных испытаний полоний-210 формировался при взрывах атомных бомб, попадал в атмосферу, а затем в растительность, почвы, воду, донные осадки. Свинец -210 также является дочерним продуктом распада урана-238 и содержание и миграция в ОПСсвязана в основном с содержанием и миграцией его материнского радионуклида-радона-222 [17, 34, 35].
Полоний-210 и свинец-210 поступают в атмосферу с летящей золой при сжигании угля в ТЭЦ, в результате чего происходит выброс в атмосферу ряда тяжелых металлов, радиоактивных элементов, в том числе полония-210 и свинца-210. Оседая из воздуха на поверхность земли под воздействием гравитационных сил или с атмосферными осадками, свинец-210 и полоний-210 задерживаются на различных компонентах биосферы (растения, почва, мхи и др.) и тем самым участвуют в миграции по пищевым цепочкам. Максимальные концентрации 210Рb - 21ОРо в воздухе вокруг ТЭС, работающих на угле, могут достигать 510 мкБк/м3. Для средних широт Северного полушария средние концентрации Ро-210 в воздухе составляют 0, 12•10-3 Бк/м3, для РЬ-210 - 0, 52 мкБк/м3. В мировой практике изучаются полоний-210 и свинец-210 в различных объектах ОПС для оценки дозовых нагрузок на биосистему.
Полоний-210 и свинец-210, являясь наиболее радиотоксичными и распространенными в ОПС естественными радионуклидами, подлежат первоочередному контролю в природных средах.
Свинец-210 является остеотропным элементом и накапливается в костной ткани, где содержится до 70 % этого радионуклида. Полоний-210, находящийся в костях, образуется в основном из своего предшественника 210Pb. В мягкие ткани полоний-210 поступает из воздуха и пищи, преобладая в тканях печени и почек.
Биологическое действие 210Po обусловлено α -излучением. Он является одним из наиболее токсичных РН из-за низкого периода полураспада и высокой энергии излучаемых α -частиц. Для 210Ро предельно допустимое содержание в воздухе составляет всего 40 миллиардных долей микрограмма в 1 м воздуха, полоний в 4 триллиона раз токсичнее синильной кислоты. Вред наносят испускаемые полонием альфа-частицы (и в меньшей мере также гамма-лучи), которые разрушают ткани и вызывают злокачественные опухоли.
Атомы полония могут образоваться в легких человека в результате распада в них газообразного радона. Кроме того, , металлический полоний способен легко образовывать мельчайшие частицы аэрозолей. Контакт с ним может привести к облучению всего организма. При высоких концентрациях 210Po развитие лучевой болезни заканчивается летальным исходом. Поэтому работа с 210Po должна вестись дистанционно в герметичных боксах с применением СИЗ [32]. Естественный вывод полония из организма (с выделениями) затруднен, так как он не входит в состав ни одного из химических соединений, участвующих в метаболизме (табл. 23).
6. Углерод-14
Углерод (лат. сarboneum) относится к неметаллам. В природе представлен стабильными 12С (98, 90 %) и 13С (1, 10 %); в земной атмосфере присутствует в ничтожных концентрациях (около 10-14 ат %). Масса нуклида 12С принята равной точно 12, а 1/12 называют атомной единицей массы.
β -радиоактивный углерод 14С (Т1/2=5730 лет) постоянно образуется на земле в результате следующих ядерных реакций: 14N (n; р)14C; 17O (n; α)14C; 13C (n; γ)14C. Эти реакции протекают как в верхних слоях атмосферы благодаря захвату космических нейтронов атомами азота по реакции 14N+п = 14C+p (при образовании природного 14С), так и при образовании техногенного радиоуглерода в результате атомных взрывов и работы атомных реакторов как промышленных, так и транспортных и исследовательских [12, 19, 34, 35].
Соотношение радиоактивного и стабильных изотопов углерода в атмосфере и в биосфере в одно и то же время в одном и том же месте одинаково, поскольку все живые организмы постоянно участвуют в углеродном обмене и получают углерод из окружающей среды, а изотопы, в силу их химической неразличимости, участвуют в биохимических процессах практически одинаковым образом. В живом организме удельная активность 14С равна примерно 0, 3 распада в сек на 1 г углерода, что соответствует изотопному содержанию 14С около 10-10 %.
Углерод существует в нескольких модификациях, свойства которых резко различны: графит, алмаз, карбин (получен искусственно). Высокочистый графит служит замедлителем нейтронов в ядерных реакторах. Алмаз применяют как абразивный материал для обработки металлов и др. материалов. Искусственный радионуклид14С в форме различных соединений используют в химических, биологических и медицинских исследованиях.
Основным поставщиком 14С является первая реакция в виду большого содержания азота (78, 08 %) в составе воздуха. Причем, в водо-графитовых реакторах (именно такой тип реактора на Сибирском химическом комбинате) образующийся на азоте 14С практически целиком выносится в атмосферу. Кроме того, в реакторах этого типа часть образующегося 14С попадает в ОПС с жидкими сбросами в виде растворимых карбонатов и углекислоты [2, 17, 23].
Существуют понятия локального и глобального загрязнения радиоуглеродом.
Источником локального загрязнения можно рассматривать не только атомный взрыв, но и каждую АЭС, предприятия ЯТЦ, изотопные производства по получению препаратов, меченых 14С, научно-исследовательские учреждения. Среднее поступление реакторного 14С в организм местных жителей, проживающих в районе действия такого источника, может составить в зонах 0-10 км – 0, 32; 10-20 км – 0, 08 мкКи/год. Зафиксированный в НРБ-99 предел годового поступления (ПГП) биологически значимого 14С в организм человека составляет 6, 3•105 Бк/год.
Глобальное радиоуглеродное загрязнение ОПС связано с развитием атомной энергетики в целом и ядерными испытаниями. При термоядерных взрывах 90% радиационного фона в атмосфере обусловлено 14С. Этот долгоживущий радионуклид (период полураспада составляет 5730 лет) включается в глобальный круговорот углерода.
Углерод-14 образуется высоко в атмосфере при столкновении космических лучей с ядрами азота [13, 34, 35]. Когда он достигает поверхности, его поглощают растения, а затем — животные, поедающие эти растения. Таким образом, углерод-14 попадает в ткани растений и животных [26]. Пока организм жив, любой распавшийся атом углерода-14 замещается таким же атомом углерода-14 из окружающей среды. Однако после смерти живого существа круговорот углерода завершается и начинается неотвратимый распад изотопа. Через 5730 лет в куске дерева останется только половина того количества углерода-14, какое было в дереве перед его гибелью (см. рис. 6).
14С реагирует с кислородом и дает 14СО2. Таким образом, углекислота всегда содержит примесь 14СО2. Участвуя в фотосинтезе, она несет 14С всем органическим веществам (углеводороды, белки, жиры и др.), образующим живой организм. Мягкое (0, 155 МэВ) β -излучение 14С также вносит свой вклад в постоянное внутреннее облучение биоты атомной радиацией. Содержание 14С в тканях растений и животных составляет 22, 7 Бк/кг углерода. Его величина колеблется для различных тканей в пределах 20-93 Бк/кг ткани. Общее содержание 14С в биосфере составляет 8, 5·1018 Бк. В течение года образуется около 1015 Бк [НКДАР, 1982].
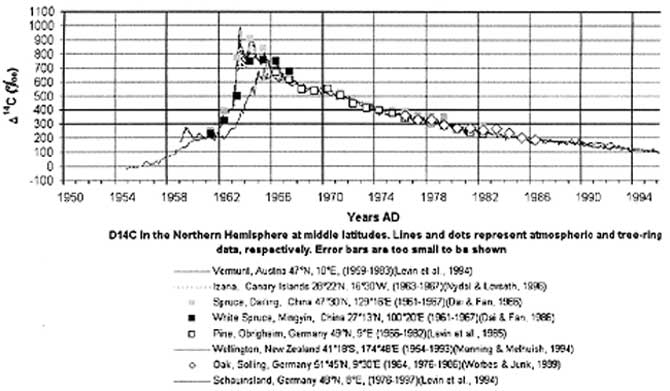
Рис. 6. Сравнение радиоуглеродного содержания в годичных кольцах деревьев из различных районов с атмосферными радиоуглеродными данными для Северного полушария
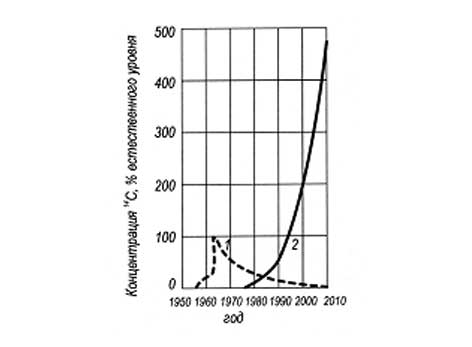
Рис. 7. Изменение содержания в биосфере искусственного 14 С бомбового (1)
и реакторного (2) происхождения (по Рублевскому В.П. и др., 1979)
Как показывают расчеты (Рублевский и др., 1979), ежегодное поступление 14С в организм человека с продуктами питания превысит естественный путь поступления 14С к 2010 г. в 5 раз, а годовая доза на все тело по сравнению с 1975 г. возрастет с 0, 04 до 7 мРад, т.е. увеличится почти в 200 раз (рис. 6) и, по подсчетам С.П. Ярмоненко, будет сказываться 11000 лет, затронув 300 поколений людей [61].
На рис. 8 показана динамика накопления 14С в волосах и крови людей от испытания ядерного оружия в атмосфере.
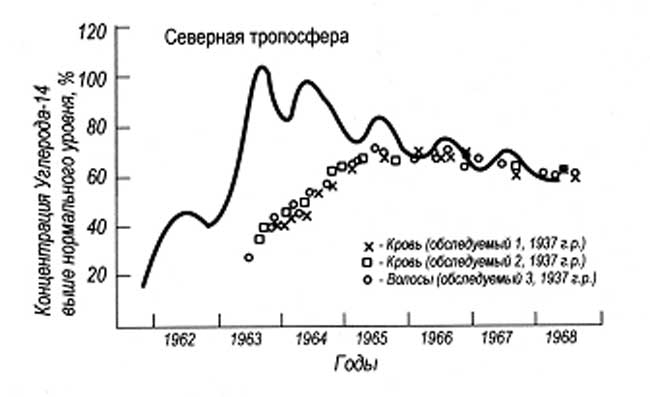
Рис. 8. Концентрация углерода-14 в тропосфере, в волосах и крови людей
в Скандинавии (по Р. Грейбу, 1994)
Опасные последствия такой динамики связаны с тем, что радиоуглерод, участвуя в обменных процессах наряду с атомами стабильного углерода, проникает во все органы и ткани организма, включаясь непосредственно в молекулы органических соединений [36, 37].
Повреждающее действие 14С, вошедшего в состав молекул белков и особенно ДНК и РНК живого организма, определяется, во-первых, радиационным воздействием β -частиц и ядер отдачи азота, возникающих в результате распада 14С по схеме 14С→ 14N; во-вторых, изменением химического состава молекулы за счет превращения атома 14С в атом 14N(β) (трансмутационный эффект в генетических структурах наследственного аппарата). Это приводит, в дополнение к эффектам от действия ионизирующего излучения, к локальным изменениям в хромосомах и, как следствие, к возникновению необратимых или трудно репарируемых мутаций разного вида. В связи с этим углерод-14 является генетически значимым фактором радиационной опасности глобального масштаба.
Такие повреждения ДНК приводят зачастую к генным мутациям второго и третьего порядков, которые практически являются необратимыми. Поэтому увеличение содержания изотопа 14С в биосфере может привести к накоплению вредных мутаций, что чревато серьезной угрозой для человечества [20, 21, 23]. Проблема мониторинга 14С является одной из основных в районах АЭС и ЯТЦ [10, 38-40].
Одним из первых отметил биологическую опасность 14С академик А.Д.Сахаров (1958), который обратил внимание на непороговые биологические эффекты радиации [41, 42]. Он рассчитал, что при испытании мегатонной бомбы только от 14С будет 2200 жертв наследственных болезней, а также обратил внимание на возможное увеличение раковых заболеваний и лейкемии. Академик А.Д.Сахаров категорически выступил против испытания ядерного оружия в атмосфере, и его усилиями было изменено решение о взрыве на Новой Земле 108 Мт бомбы (в 1961 г. взрывали только 58 Мт, что составляет около 10% от мощности всех атмосферных ядерных взрывов).
Пик концентрации в атмосфере «бомбового» 14С пришелся на 1965 г. (рис. 6), когда его значения превысили в 1, 7 раза концентрацию атмосферного радиоуглерода до начала испытаний. Одной из главных причин запрета испытаний ядерного оружия в атмосфере был прогнозируемый рост смертности людей в связи с увеличением концентрации радиоуглерода в атмосфере и его поступление в организм человека по биологическим цепочкам. Допускаемые ныне ПГП 14С в НРБ-99 (20-тикратное превышение содержания радиоуглерода в пище по сравнению с его естественным уровнем концентрации в биосфере) существенно выше тех, которые принимались во внимание политиками при принятии решения о запрете ядерных испытаний и которые реально привели в свое время к повышению смертности, например в Дании (рис. 9), и других во многом благополучных странах [43].

Рис. 9. Динамика естественной смертности населения Дании в возрасте 67 лет [43]. Линии 1, 2, 3 – мужчин; линии 4, 5, 6 – женщины; 1 и 4 – смертность;
2 и 5 – вероятный ход кривых смертности после 2002 года; 3 и 6 – основной тренд исторической динамики смертности
Таким образом, очевидна необходимость ужесточения НРБ-99 в части радикального снижения допустимого уровня поступления радиоуглерода с пищей.
7. Тритий
Радиоактивный сверхтяжелый радионуклид водорода тритий 3H (период полураспада T1/2=12, 35 года) подобно радиоуглероду постоянно образуется в атмосфере в результате взаимодействия космического излучения с ядрами атомов азота, кислорода и аргона (например, по реакции 147N+10n→ 126C+31H), а также при расщеплении ядер различных элементов космическими лучами большой энергии. При β -распаде превращается в гелий-3.
Тритий 3Н, получающийся в атмосфере в результате ядерных реакций космических нейтронов с ядрами азота и кислорода, в основном превращается в тритиевую воду, которая с осадками выпадает на землю и участвует в нормальном круговороте воды [34, 35]. В соединении с кислородом тритий образует сверхтяжелую воду Т2О. Содержание трития в континентальных водах колеблется в пределах 200-900 Бк/м3. Воды океана содержат около 100 Бк/ м3 [Kaufman, Libby, 1954]. Глобальная годовая наработка природного трития составляет ~1·1018 Бк. В 1 литре воды в среднем содержится 3, 2ּ 10-10 г трития, в 1 л воздуха - 1, 6 10-14 г (при абсолютной влажности 10 мг/л). Образуется тритий в верхних слоях атмосферы с участием космического излучения со скоростью 1200 атомов в сек в расчете на 1 м2 земной поверхности. Таким образом, в течение тысячелетий содержание трития в природе было почти постоянным – непрерывное его образование в атмосфере компенсировалось естественным распадом.
Однако с 1954 г. (начало испытаний термоядерных бомб) положение резко изменилось и в дождевой воде содержание трития увеличилось в тысячи раз. Взрыв водородной бомбы мощностью 1 Мт приводит к выделению от 0, 7 до 2 кг трития. Общая мощность воздушных взрывов составила за 1945-1962 гг. 406 Мт, а наземных –104 Мт. При этом общее количество трития, поступившее в биосферу в результате испытаний, составило сотни килограммов! После прекращения наземных испытаний уровень трития пошел на убыль. В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
Искусственно тритий привносится во внешнюю среду двумя путями:
• во время атомных и термоядерных взрывов, которые приводят к увеличению концентрации 3H в дождевой воде в 10-100 раз;
• при производстве ядерной энергии на двух этапах топливного цикла (работе реакторов и переработке ОЯТ).
Природный тритий образуется, например, при бомбардировке азота нейтронами космических лучей: 147N+10n = 31T+342He. Техногенный тритий возникает в ядерных реакторах за счет взаимодействия ядер лития с нейтронами: 63Li+10n = 31T+42He. Молекула трития двухатомна. В обычных условиях Т2 – газ, tпл= –252, 52°С, tкип= –248, 12°С.
Наработка трития в ядерных реакторах зависит от типа ядерной установки и колеблется в пределах 2-10 Ки/год на 1 МВт тепловой мощности. Среднегодовое глобальное поступление трития за счет ядерного топливного цикла составляет ~1016 Бк, то есть небольшую долю от естественного природного образования [34, 35, 44].
Запасы природного трития ничтожны. Глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Подсчет показал также, что во всех водоемах Земли трития содержится всего лишь 100 кг. Поэтому весь тритий, используемый для различных целей, получают искусственно, путем облучения лития нейтронами. В результате стало возможным получить значительные количества чистого трития и изучить его свойства, а также свойство его соединений. Так, сверхтяжелая вода Т2О имеет плотность 1, 21459 г/см3.
Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Например, сульфид цинка, содержащий небольшое количество соединений трития (примерно 0, 03 мг на 1 г светосостава), непрерывно излучает зеленый свет. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития [45 - 48].
Тритий используется также в светоисточниках: для промышленных знаков «выход», для маркеров безопасности, люминесцентных дорожных знаков, знаков и маркеров для авиационной промышленности и т.п. Для изготовления светоисточников ежегодно используется около 1015 Бк трития.
Тритий является одним из основных компонентов взрывчатого вещества термоядерных (водородных) бомб, а также весьма перспективен для проведения управляемой термоядерной реакции по схеме D + T > 4Не + n [47].
Большое поступление трития в геосферу связано с испытаниями водородных бомб и составило к концу испытаний (1962 г.) 2, 6·1020 Бк, что значительно превосходило природное накопление трития.
Образуемый ядерными реакторами 3H может находиться в форме H3HO, Д3НО, Н3Н, 3Н2, тритидов металлов и органических производных. Вследствие утечек и недостатков в технологии обращения с РАО (в которой 3Н практически не улавливается) выброс трития в ОПС осуществляется с газообразными и жидкими отходами.
При переработке облученного топлива 3H высвобождается из отработавших тепловыделяющих элементов (ТВЭЛов). Гипотетический завод мощностью 1500 т/год может сбросить в атмосферу около 30 кБк/год трития [47].
На других этапах производства ядерной энергии к источникам 3Н в биосфере следует отнести хранилища РАО. Хранение и захоронение низко - и среднеактивных РАО в поверхностных слоях грунта приводит к выделению на поверхность диффундирующих 32Н и Н3НО, а также к образованию и выделению тритированного метана СН33Н и других органических соединений, к появлению Н3НО в грунтовых водах.
Общий запас трития в биосфере оценивается в 1, 3·1018 Бк. Вода составляет значительную компоненту живого организма, постоянно обмениваясь с водой ОПС. Она будет всегда содержать следы тритиевой воды, непрерывно облучая все ткани организма мягким (0, 01795 МэВ) β -излучением трития. Средняя концентрация трития в живых тканях равна 0, 4 Бк/кг [НКДАР, 1982].
Наличие поверхностных водоемов-хранилищ ЖРО приводит к проникновению РВ в грунтовые подземные воды. Минуя очистные барьеры, образовавшийся на АЭС тритий (или радиоактивный водород) поступает в ОПС с жидкими сбросами в виде тритиевой воды и газообразными выбросами. Например, в США река Саванна заражена тритием в основном из-за деятельности, связанной с производством ядерного оружия в промышленном ядерном комплексе Саванна-Ривер-Сайт (Savannah River Site).
Загрязнение тритием грунтовых вод имеет место практически при нормальной эксплуатации большинства российских АЭС. Наличие трития вокруг АЭС скоро станет главной головной болью. Промышленные выбросы и случайные утечки могут стать более широкой проблемой для коммерческих АЭС, чем было принято считать раньше. Тритий легко связывается протоплазмой живых клеток и тысячекратно накапливается в пищевых цепочках [13, 17, 20, 23, 58].
По заключению специалистов, тритий следует рассматривать как ведущий радионуклид по вкладу в эффективные дозы облучения населения за период деятельности ПО «Маяк». Потенциальная опасность облучения населения за счет трития будет возрастать при продолжающихся работах на предприятиях ЯТЦ и вводе в эксплуатацию новых реакторов АЭС, особенно на быстрых нейтронах. Если в настоящее время эффективная эквивалентная доза, обусловленная тритием, не превышает в среднем на одного человека 0, 05% от естественного фона, то с увеличением числа работающих реакторов во всех странах она может через 60-70 лет достигнуть 1%. Это без учета потенциальной возможности возникновения радиационных аварий [44-47].
В организм человека 3Н поступает в виде газа и тритиевой воды 1Н3НО через легкие, кожу и желудочно-кишечный тракт (12%). Газообразный Т2 в 500 раз менее токсичен, чем сверхтяжелая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации. В среднем организм человека содержит 5·10-12 г трития, что дает вклад 0, 13 мбэр в общую дозу годового облучения (это в сотни раз меньше облучения от других источников радиации). У людей, носящих часы, в которых стрелки и цифры покрыты тритиевым люминофором, содержание трития в теле в 5 раз выше среднего. Установлено, что поступивший в организм человека 3Н существует в виде двух отдельных соединений: свободной тритиевой воды 1Н3НО и органически связанного 3Н (ОСТ). Для критической группы населения допустимая концентрация трития в воде – 7, 7·103 Бк/л воды. Он относится к средней группе радиотоксичности.
Тритий – чистый β -излучатель со средней энергией излучения 0, 018 МэВ, что на два порядка меньше энергии β -излучения радиоуглерода. С этим связана особенность повреждений тканей, производимых тритием [17, 20, 23]. Радиоактивный распад трития приводит к нарушению молекулярных структур и межмолекулярных связей под действием β -излучения, а также в результате превращения трития в изотоп гелия. Обладая наименьшей энергией β -частиц, тритий создает значительную плотность ионизации ткани (число пар ионов, образуемых заряженной частицей на единице ее пути). Кроме того, пробег β -частиц трития значительно меньше геометрических размеров клеток, поэтому поражение тритием локализуется возле самого изотопа, и общее поражение зависит от геометрии его распределения в тканях организма и микрогеометрии распределения в клетке (Мушкачева и др., 1994). Атомы трития замещают в молекулах ткани атомы водорода.
Эффективный период полувыведения трития из организма Тэф= 12 суток. ОСТ представляет более серьезные факторы риска, чем тритиевая вода при одинаковом количестве поглощения трития. Половина тритиевой воды выходит из организма каждые 10 дней, при этом удаление половины ОСТ из организма занимает от 21 до 76 дней. Для некоторых молекул с очень медленной скоростью перехода это время может увеличиться до 280-550 дней.
Более длительное время удержания ОСТ в организме вызывает особое беспокойство, если тритий проникает в такие ткани, как нейроны (основные клетки нервной системы) или ооциты (незрелые яйцеклетки). Учитывая, что формирование яичников у женщин происходит раз в жизни, воздействия радиации на репродуктивную систему внутриутробного плода женского пола, а также возможное воздействие на детей, матери которых были облучены внутриутробно, могут быть значительными.
Особым примером явного влияния ОСТ является тритиевый тимидин. Эксперименты показывают, что тритиевый тимидин (органическое соединение, которое может быть инкорпорировано в соств ДНК) на определенных стадиях эмбрионального развития у мышей наносит вреда более чем в 1000 раз по сравнению с тритиевой водой при одинаковых концентрациях. Такая огромная разница не может быть примером для всех форм ОСТ, поскольку тимидин – это предшественник ДНК. Однако этот случай демонстрирует крайнюю необходимость в изучении особых химических форм трития, в особенности, органически связанных [23, 45].
Вред, нанесенный плоду органически связанным тритием, более чем в четыре раза превышает вред, нанесенный взрослому человеку тритиевой водой, и почти в десять раз превышает цифры действующих моделей.
Помимо вопросов, связанных с моделями для оценки раковых рисков, оценки факторов риска от трития, которые ориетированы лишь на раковые заболевания, преуменьшают его реальные воздействия. К повышенным рискам у беременных и эмбриона (плода) относятся ранние выкидыши, пороки развития и генетические нарушения. Риски также могут передаваться через много поколений, учитывая, что яичники у женщины формируются еще в утробе.
Необходимо провести еще много дополнительных исследований тритиевых воздействий на здоровье. Необходимо изучать эффекты внутриутробного облучения тритием в комбинации с токсинами, например, химикатами, нарушающими эндокринную систему, - аналогично тому, как изучаются потенциальные неврологические эффекты.
Биологическое воздействие трития усиливается тем, что при его распаде образуется инертный гелий 32Не, поэтому водородные связи в этом месте будут рваться, а это должно сказываться как на нарушении процесса синтеза органических структур при жизни индивида, так и оказывать воздействие на отдаленную наследственность.
Из вышесказанного следует необходимость контроля за содержанием трития в ОПС и продуктах питания, прежде всего, вблизи производств ядерно-топливного цикла (ЯТЦ).