
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Криптон-85
|
|
Криптон (kripton) Kr – химический элемент VIII группы Периодической системы элементов, инертный газ без цвета и запаха, атомный номер 36, атомная масса 83, 80. На Земле присутствует главным образом в атмосфере. Вместе с ксеноном и неоном открыт в 1895-1898 гг. шотландским химиком Уильямом Рамзаем (совместно с М.Траверсом) в воздухе в ничтожном количестве (в сумме 0, 01%). Природный криптон состоит из 6 стабильных изотопов: 78Kr, 80Kr, 82Kr, 83Kr, 84Kr и86Kr, среди них наиболее распространен 84Kr (57, 0 %), наименее – 78Kr (0, 35 %).
По данным Томаса Кохрана и др. (1992), Сибирский химический комбинат (СХК) выбрасывает в атмосферу 3 изотопа этой группы:
85 Kr 330 000 кКи/год,
131Xe 190 кКи/год,
133Xe 540 кКи/год.
Просачивающийся сквозь изоляционное покрытие ТВЭЛов 89Kr менее опасен, поскольку он распадается до радиоактивного стронция, составляет незначительную долю, к тому же его период полураспада 3 мин, и поэтому он имеет значение только в пределах зон, близких от реактора. Ксенона Xe (атомный номер 54) в воздухе мало – 0, 008 мл/м3, свое название он получил как характеристика чужеродности в порции криптона. Время жизни изотопов Xe исчисляется несколькими сутками, и через 10-30 ч они полностью выводятся из организма.
85Kr имеет период полураспада 10, 72 года и его воздействие на организм требует серьезного отношения и дальнейшего изучения. В малых количествах 85Kr присутствует в ОПС вследствие спонтанного и вызванного нейтронами деления природного урана, а также вследствие облучения нейтронами космического излучения атомов атмосферного 84Kr [48, 49].
Количество 85Kr в атмосфере в последние годы существенно возросло (рис. 9) и по прогнозам мощность дозы облучения кожи за счет этого фактора может возрасти к 2010 г. более чем в 100 раз, составив примерно 0, 03 Зв/год.
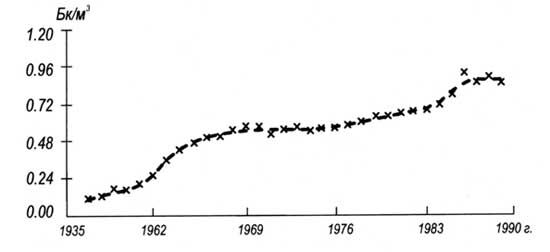
Рис. 10. Среднегодовая объемная активность криптона-85 в атмосфере (по Капухину В.Н. и др., 1995)
Распад 85Kr сопровождается испусканием β -частицы, либо β -частицы и γ -кванта [22].
В настоящее время основным источником поступления 85Kr в ОПС являются предприятия по производству плутония. Кроме того, 85Kr может поступать в атмосферу от производимых в мирных целях атомных взрывов и работы атомных реакторов, в том числе, и реакторов морских судов, но их выбросы будут незначительными по сравнению с выбросами заводов по производству плутония. Большие количества β -радиоактивного 85Kr образуются при работе ядерных реакторов. Для очистки газообразных отходов ядерной энергетики от 85Kr и т.п. примесей используют сорбцию на активированном угле и другие методы.
Химическая активность криптона крайне низкая, непосредственно реагирует только со фтором. Криптон применяют главным образом в электровакуумной технике для заполнения ламп накаливания, тиратронов, люминесцентных трубок. Стеклопакеты заполняют криптоном, что повышает сопротивление теплопередаче. Криптон-аргоновый лазер способен излучать свет в различных длинах волн красного, синего и зеленого диапазонов.
Будучи инертным, он не вступает в химические соединения, а накапливается в атмосфере, не вовлекается в биологические процессы, а адсорбируется в тканях тела при вдыхании и растворяется в биологических жидкостях. Он характеризуется низкой растворимостью в крови, высокой растворимостью в липидах и быстрой диффузией в тканях. Есть сведения о высоком поглощении 85Kr корой надпочечников [10, 23].
Органом, наиболее подверженным воздействию 85Kr, является кожа, но она и наиболее устойчива к радиоактивному облучению. Однако, параллельное воздействие ультрафиолетового излучения может усилить негативный эффект. Оба воздействия носят как мутагенный, так и канцерогенный характер. Механизм мутагенеза этих двух факторов различен (β -излучающий 85Kr производит разрыв в цепях ДНК, а ультрафиолетовое облучение (УФО) образует в них тиминовые димеры), канцерогенное же воздействие этих факторов в принципе не отличается.
В связи с продолжающимся развитием ядерной энергетики на земном шаре вопрос об очистке газовых отходов от радиоактивных газов должен рассматриваться в международном масштабе (на уровне МАГАТЭ и МКРЗ).
9. Йод-131 и -129
Свободный йод был получен парижским селитроваром Куртуа в 1811 г. Название «йод» происходит от греческого слова «иодэс», что значит «фиолетовый» (по цвету паров). В свободном виде йод – черно-серое кристаллическое вещество с металлическим блеском.
Йод – один из активных металоидов природы. Поэтому в природе в свободном виде не встречается. Важнейшие соединения йода – йодистые калий и натрий. Эти соединения, несмотря на то, что природа сравнительно бедна йодом, распылены в ней очень широко.
Главным резервуаром йодистых соединений является вода морей и оксидов. Водоросли (ламинария и др.) способны накапливать соединения йода в значительных количествах. Водоросли и служат источником получения чистого йода. Из обычных продуктов питания наиболее богаты йодом лук и морская рыба.
В настоящее время известно 24 изотопа йода, из которых радиоэкологическую опасность представляют в основном 2 изотопа: йод-131 и йод-129. Наибольшее значение в практическом отношении имеет изотоп-131, также используются и радиоактивные изотопы 132 и 133. Изотоп йода-131 является бета- и гамма-излучателем, был выделен в 1938 г. Ливингудом и Сиборгом из теллура, облученого нейтронами и дейтронами. Затем он был обнаружен Абельсоном в продуктах деления урана и, наконец, в продуктах деления тория-232.
Период полураспада йода-131 всего 8, 04 суток. Этим обусловлена его сравнительно невысокая опасность и возможность медикаментозной помощи [50].
Йод-129 относится к числу наиболее радиологически значимых нуклидов в глобальном масштабе благодаря своему периоду полураспада, который оценивается в 17 млн лет. Его вклад в ОПС в отдаленной перспективе оценивается значительным. Активно включаясь в глобальный цикл, йод-129 является потенциальным глобальным облучателем на протяжении миллионов лет.
Антропогенными источниками этих изотопов могут быть заводы по переработке облученного ядерного топлива, АЭС и атомные взрывы. Непосредственно в реакции деления выход этих изотопов невелик, но они образуются в значительных количествах из своих радиоактивных предшественников: 129I из 129mTe и 129Te, а 131I из131mTe и 131Te [50, 51].
В обычном режиме работы АЭС выбросы йода также невелики, но в аварийных ситуациях радиоактивная опасность обуславливается (в начальный период) именно изотопами йода, поступающими в организм в основном перорально и через органы дыхания.
В табл. 16 приведены основные характеристики радионуклидов йода, поступающих в ОПС при аварии на ядерном реакторе.
Обладая высокой миграцией, он быстро включается в биологические цепи и становится источником внешнего и внутреннего облучения. Йод-131 является вреднейшим радиоактивным веществом и представляет большую опасность для здоровья людей даже в мизерных дозах. Его биологическая доступность очень высока. Йод-131 может попадать в организм человека и с вдыхаемым воздухом, и с употребляемой пищей, например, со свежими молочными продуктами и с выращиваемыми на местных огородах и дачных участках овощами, листовой зеленью.
В организме человека радиоактивный йод концентрируется, прежде всего, в щитовидной железе, вызывая серьезнейшие осложнения. Особенно большие дозы формируются в щитовидной железе детей, что обусловлено ее малыми размерами, и могут в 2-10 раз превышать дозу облучения щитовидной железы (ЩЖ) у взрослого. Радиоактивный йод из организма беременной женщины поступает к плоду, в железе которого поглощаемая доза в десятки раз больше, чем в ЩЖ матери [21, 23].
Проблема радиационно-индуцированной патологии ЩЖ стала особенно актуальной после аварии на Чернобыльской АЭС, когда большие группы населения подверглись воздействию внешнего и внутреннего излучения, в том числе йода-131; к фактору йодной недостаточности присоединился радиационный [52, 53]. Расстройства организма, связанные с недостаточным поступлением йода в организм, проявляются в развитии зоба, большой обезображивающей опухоли на шее. В Китае больных зобом лечили золой морских губок (которая содержит до 8, 5% йода) еще очень давно. Ежедневное потребление небольших доз йодистых солей (в виде примесей к поваренной соли) дает возможность полностью избавиться от зоба.
Таблица 16
Радиационные характеристики радионуклидов йода
| Радио-нуклид | Период полураспада | Гамма-постоянная, Гр.м2/(с·Бк) | Эффективная энергия гамма-излучения, МэВ/распад | Доза в щитовидной железе от 1 ГБк до полного выведения, Гр |
| 131I | 8, 04 сут | 14, 1 | 0, 37 | 1, 6 |
| 132I | 2, 3 ч | 82, 5 | 0, 76 | 0, 06 |
| 133I | 20, 8 ч | 22, 0 | 0, 58 | 0, 46 |
| 134I | 0, 876 ч | 91, 1 | 0, 85 | 0, 23 |
| 135I | 6, 61 ч | 55, 3 | 1, 13 | 0, 14 |
Проблема йода-129 заключается в том, что этому радионуклиду практически не уделяется внимания. Разработанные в настоящее время методы изоляции йода-129 вместе с РАО обеспечат эту изоляцию лишь на несколько столетий, затем хранилища разрушатся и весь йод-129 рассеется в биосфере [10].
Расчеты скорости выщелачивания, миграции с подземными водами, конвекционного переноса с учетом сорбции и полураспада йода-129 показали, что через 1000 лет из хранилища в биосферу возможно его поступление 13 ГБк/год.
Глобальный вклад йода-129 в ожидаемую дозу облучения за счет ЯТЦ обусловлен на период интегрирования от 10 до 108 лет поступлением от заводов по переработке ТВЭЛов и составит 40 ГБк на 1ГВт (эл.)∙ год. К настоящему времени суммарный выброс йода-129 в атмосферу достиг 1012 Бк. При планируемых темпах развития ядерной энергетики к 2010 г. будет накоплено 4∙ 1014 Бк йода-129.
Специфика йода заключается в многообразии его химических соединений [2-5, 50]. К наиболее активным формам относится элементарный йод, который под воздействием различных факторов образует многочисленные химические соединения, взаимодействует с твердыми атмосферными частицами, адсорбируясь на их поверхности. Легко испаряется с образованием фиолетовых паров, имеющих резкий запах. Элементарный йод используют для получения сверхчистых Ti, Zr и других металлов (образование летучих иодидов металлов с их последующим разложением при высокой температуре), для заполнения колб мощных иодных ламп.
Элементарный йод и его препараты широко используют в медицине, где его применяют для определения функции щитовидной железы, а также для лечения ряда ее заболеваний (гипертиреоза, злокачественных новообразований и др.), для предупреждения атеросклероза и при лечении ряда болезней внутренних органов и нервной системы. Способность некоторых веществ, содержащих йод, накапливаться в опухолевых тканях, нашла себе применение в использовании таких веществ с радиоактивными изотопами йода для точного определения местоположений опухолей в мозгу. Это главная, но не единственная область его применения.
Главными потребителями йода являются фармацевтическая, химическая промышленность и производство светочувствительных фотоматериалов. Соединения йода используют как катализаторы при изготовлении фото- и киноматериалов. Из искусственно полученных радионуклидов йода наибольшее значение имеют 125I (электронный захват, Т1/2 = 60, 14 сут) и β –-радиоактивные 131I (T1/2 = 8, 04 сут) и 132I (T1/2 = 2, 28 ч), которые широко используются в сельском хозяйстве. При добавлении в пищу йодсодержащих водорослей у коров увеличивается удой молока, а у овец быстро растет шерсть. Замечено также благотворное влияние небольших доз йодистых соединений на яйценосность кур, откорм свиней.
Радионуклид 131I в больших количествах содержится в продуктах деления. Из всего вышесказанного следует, что проблемы радиоэкологии йода многогранны и требуют создания модели биогеохимического круговорота йода в глобальном масштабе, как краткосрочного, так и долгосрочного прогнозов.
10. Стронций-90
Стронций – элемент главной подгруппы вторгой группы пятого периода Периодической системы химических элементов Д.И.Менделеева с атомным номером 38. Обозначается символом Sr (лат. strontium), атомная масса 87, 62. Обнаружен в минерале стронцианите, найденном в 1764 г. в свинцовом руднике близ шотландской деревни Строншиан, давшей впоследствии название новому элементу. Присутствие в этом минерале оксида нового металла было установлено почти через 30 лет Уильямом Крюйкшенком и Адером Кроуфордом. Выделен в чистом виде сэром Хемфри Дэви в 1808 г. [3. 4]. Среднее содержание стронция в земной коре (кларк) 3, 4∙ 10-2% по массе, в геохимических процессах он является спутником кальция. Известно около 30 минералов стронция; важнейшие – целестин SrSO4 и стронцианит SrCO3.
В свободном виде − это мягкий, ковкий и пластичный щелочно-земельный металл серебристо-белого цвета. Природный стронций − смесь стабильных 84Sr, 86Sr –88Sr, в которой преобладает 88Sr (82, 58 %), а меньше всего 84Sr (0, 56 %). Химически высокоактивен, реагирует с кислородом и азотом воздуха. По химическим свойствам аналогичен кальцию и барию [2, 54]. Температура плавления – 768 С°, температура кипения - 1390°С. Искусственно получены радиоактивные изотопы с массовыми числами от 80 до 97. Распространенность изотопов стронция варьируется в связи с образованием 87Sr за счет распада природного 87Rb. По этой причине точный изотопный состав стронция в породе или минерале, которые содержат рубидий, зависит от возраста и отношения Rb/Sr в данной породе или минерале.
Содержится в природных минерализованных водах (около 24% общих запасов стронция). Среднее содержание стронция в почвах 0, 035% по массе, в морской воде (0, 1 мг/л), в речной воде 0, 08 мг/л. Часть стронция в океане концентрируется в железомарганцевых конкрециях (4900 т в год).
Долгоживущие радиоактивные изотопы 89Sr и 90Sr образуются (с высоким выходом) при делении ядер урана. Наибольшую опасность представляет 90Sr из-за большого периода полураспада, способности накапливаться в организме и высокой энергии β -излучения его ДПР 90Y. Основные характеристики радиотоксичного90Sr представлены в табл. 17.
Таблица 17
Основные характеристики стронция-90
| Изотоп | Основной вид излучения | Период полураспада, ТЅ | Значение УВвода, Бк/дм3 | Природные вариации ОА в водах (min-max), Бк/дм3 |
| 90Sr | β (Emax=546 кэВ; E средн = 196 кэВ) Есредн=196 кэВ) | 28, 6 лет | 5, 0 (НРБ-99) | n·10-2-n |
| 90Y (ДПР 90Sr) | β (Emax=2274 кэВ; Есредн=928 кэВ) | 64, 1 ч | — | n·10-2-n равновесие с 90Sr |
Основные области применения стронция и его химических соединений - это радиоэлектронная промышленность, пиротехника, металлургия, пищевая промышленность, металлотермия, производство магнитных материалов, атомных электрических батарей, атомно-водородная энергетика, радиоизотопные термоэлектрические генераторы.
Применяется для изготовления β -излучающих источников и эталонов, в радиоактивных индикаторах, а также в медицине. Стронций чистотой 99, 99-99, 999% применяется для восстановления урана. В качестве примера промышленных устройств следует привести β -электронные реле, быстродействующие сигнальные или регулирующие устройства в стрелочных измерительных приборах (амперметрах, вольтметрах, манометрах); нейтрализаторы статического электричества и толщиномеры. В технике сверхвысоких частот он служит в качестве материала для диэлектрических антенн, фазовращателей и других устройств.
Металлический стронций используют в качестве газопоглотителя в электронно-вакуумных приборах, его добавляют в алюминиевые и другие специальные сплавы. Фторид стронция – люминофор, лазерный и оптический материал, используется в качестве компонента твердотельных фторионных аккумуляторных батарей с громадной энергоемкостью и энергоплотностью. Добавка оксида стронция (SrO) в стекла улучшает их радационную стойкость. Соли стронция (нитрат стронция Sr(NO3)2 и др.) применяют в пиротехнике для окрашивания пламени. Титанат стронция используется в качестве сегнетоэлектрика, он входит в состав пьезокерамики.
Уранат стронция играет важную роль при получении водорода (стронций-уранатный цикл, Лос-Аламос, США) термохимическим способом (атомно-водородная энергетика), и, в частности, разрабатываются способы непосредственного деления ядер урана в составе ураната стронция для получения тепла при разложении воды на водород и кислород. Радиоактивный 90Sr применяется в производстве радиоизотопных источников тока в виде титаната стронция (плотность 4, 8 г/см3, а энерговыделение около 0, 54 Вт/ см3). Пленки из титаната стронция используют при изготовлении нелинейных конденсаторов и датчиков инфракрасного излучения. С их помощью создают слоистые структуры диэлектрик – полупроводник – диэлектрик – металл, которые применяются в фотоприемниках, запоминающих устройствах и других приборах.
Магнитотвердые ферриты стронция – широкоупотребительные материалы для производства постоянных магнитов. Европа потребляет львиную долю карбоната стронция для производства ферритовых стронциевых магнитов, которые используются в автомобильной промышленности, где они применяются для магнитных задвижек в дверцах автомобилей и тормозных системах. В США и Японии карбонат стронция используют преимущественно в производстве телевизионного стекла кинескопов для цветных телевизоров и компьютеров, керамических ферритовых магнитов, керамических глазурей, зубной пасты, антикоррозионных и фосфоресцирующих красок, высокотехнологичной керамики, в пиротехнике. Наиболее емкими направлениями потребления являются первые два.
Стронций применяется для легирования меди и некоторых ее сплавов, для введения в аккумуляторные свинцовые сплавы, для обессеривания чугуна, меди и сталей. Сплавы стронция с оловом и свинцом применяются для отливки токоотводов аккумуляторных батарей, сплавы стронций-кадмий для анодов гальванических элементов. Оксид стронция применяется в качестве компонента сверхпроводящих керамик. Сульфид стронция применяется как компонент люминофоров, фосфоресцирующих составов, средств для удаления волос в кожевенной промышленности. Бромид стронция используется в качестве оптического материала. Иодид стронция служит в качестве люминесцентного материала в сцинтилляционных счетчиках. Хлорид стронция используется в пиротехнических составах. Его приманяют также в холодильной технике, медицине, косметике. Фторид стронция используется в качестве оптического и ядерного материала, компонента специальных стекол и люминофоров.
Радиоизотоп стронция применяется в производстве атомных электрических батарей. Элементы из радиоактивного стронция, соединенные в миниатюрную батарейку (размером со спичечную коробку), способны безотказно служить без перезарядки 15-25 лет, такие батареи незаменимы для космических ракет и искусственных спутников Земли. Швейцарские часовщики с успехом используют крохотные стронциевые батарейки для питания электрочасов.
Отечественными учеными создан изотопный генератор электрической энергии для питания автоматических метеостанций на основе стронция-90. Гарантийный срок службы такого генератора – 10 лет. Все обслуживание его заключается лишь в профилактических осмотрах – раз в два года. Первые образцы генератора установлены в Забайкалье и в верховьях таежной речки Кручины.
В Таллине работает атомный маяк. Главная его особенность – радиоизотопные термоэлектрические генераторы, в которых в результате распада стронция-90 возникает тепловая энергия, преобразуемая затем в световую.
Радиоактивный стронций нашел применение в качестве изотопного индикатора при исследовании кинетики различных процессов. Именно этим методом в опытах с животными установили, как ведет себя стронций в живом организме: где преимущественно он локализуется, каким обрзом участвует в обмене веществ. Тот же изотоп применяют в качестве источника излучения при лучевой терапии. Аппликаторами со стронцием-90 пользуются при лечении глазных и кожных болезней.
При делении ядер U в ядерных реакторах и при взрывах ядерного оружия образуются занчительные количества β -радиоактивных нуклидов стронция: 89Sr (Т1/2 = 50, 5 сут) и 90Sr (Т1/2= 29, 12 года), которые представляют большую опасность для окружающей среды (особенно 90Sr), так как длительное время находятся в поверхностном слое Земли и обладают высокой миграционной способностью.
90Sr обладает высокой химической активностью, на воздухе быстро реагирует с влагой и кислородом, покрываясь желтой оксидной пленкой. Стронций-90 характеризуется большой подвижностью, сравнительно слабо задерживается почвенными сорбируюшими комплексами, в связи с чем, может мигрировать на большие расстояния. Формы существования 90Sr в водной среде зависят от условий его образования. Предельно допустимая концентрация стронция в воде в РФ – 8 мг/л, а в США – 4 мг/л.
Стронций хорошо усваивается растениями, наилучшим образом поглощаясь из водного раствора. Внесение в почву содержащих кальций органических удобрений и извести снижает поступление стронция в растения. При наземных ядерных взрывах образуются легкорастворимые формы и 90Sr присутствует в поверхностных водах в виде устойчивого двухвалентного иона. При подземных ядерных взрывах часть 90Sr может находиться в форме нерастворимых соединений (например, силикатов), что может существенно ограничить его миграцию.
Стандартные радиохимические методики определения 90Sr в природных водах основаны на выделении стронция и последующем измерении β -излучения радиохимически чистого препарата либо самого стронция, либо после накопления и дополнительной очистки продукта его распада 90Y.
Основными способами концентрирования 90Sr из природных вод являются соосаждение с карбонатом кальция и сорбция на катионообменных смолах.
При анализе концентрата используются различные методы: осаждение, ионный обмен, экстракция в разных модификациях (жидкостный или твердофазный варианты).
Стронций – составная часть микроорганизмов, растений и животных. У морских радиолярий скелет состоит из сульфата стронция – целестина. Морские водоросли содержат 26-140 мг стронция на 100 г сухого вещества, наземные растения – около 2, 6, морские животные – 2-50, наземные животные – около 1, 4, бактерии – 0, 27-30. Накопление стронция различными организмами зависит не только от их вида, особенностей, но и от соотношения содержания стронция и других элементов, главным образом кальция и фосфора, в окружающей среде.
Животные получают стронций с водой и пищей. Некоторые вещества, например полисахариды водорослей, препятствуют усвоению стронция. Стронций накапливается в костной ткани, в золе которой содержится около 0, 02% стронция (в других тканях – около 0, 0005%).
Попадая в окружающую среду, 90Sr включается (главным образом вместе с Ca) в процессы обмена у растений, животных и человека. В растения 90Sr может поступать непосредственно через листья или из почвы через корни. Относительно больше 90Sr накапливают бобовые, клубни и корнеплоды, меньше – злаки. В семенах и плодах его значительно меньше, чем в листьях и стеблях [20, 21].
Не следует путать действие на организм человека природного (нерадиоактивного, малотоксичного и более того, широко используемого для лечения остеопороза) и радиоактивных изотопов стронция [54]. Влияние нерадиоактивного стронция проявляется крайне редко и только при воздействии других факторов (дефицит кальция и витамина Д, неполноценное питание, нарушения соотношения микроэлементов таких, как барий, молибден, селен и др.). Тогда он может вызывать у детей «стронциевый рахит» и «уровскую болезнь» - поражение и деформация суставов, задержка роста и другие нарушения. Напротив, радиоактивный стронций практически всегда негативно воздействует на организм человека: откладывается в скелете (костях), поражает костную ткань и костный мозг, что приводит к развитию лучевой болезни, и кроветворной ткани и костей, вызывает лейкемию и злокачественные опухоли (рак) костей, а также поражение печени и мозга. Кроме того, излучение действует на молекулы ДНК и, следовательно, влияет на наследственность пагубно.
Природный стронций является стабильным. Он входит в состав микроорганизмов, растений, животных и человека, являясь строительным материалом костной ткани. Избыток в ней стронция (выше 0, 02%) может вызвать ломкость костей, рахит и другие заболевания. Загрязнение стронцием представляет серьезную опасность для здоровья, так как предельно допустимое содержание его в теле человека задается величиной 1мкКи. Стронций, имея период полувыведения из человеческого организма 15, 3 года, обладает способностью накапливаться в костной ткани, причем особенно быстро при ее интенсивном образовании (в детском возрасте, при сращении переломов) [23, 54].
Содержание стронция-90 в человеческом организме находится в прямой зависимости от общей мощности взорванного атомного оружия. Он попадает в организм при вдыхании радиоактивной пыли, образующейся в процессе взрыва и разносимой ветром на большие расстояния. На радиационную обстановку существенно влияет наличие загрязненных зон, появившихся вследствие аварий на Чернобыльской АЭС в 1986 г. и на ПО «Маяк» в Челябинской области в 1957 г. (Кыштымская авария), а также в окрестностях некоторых предприятий ядерно-топливного цикла. Другим источником заражения служат питьевая вода, растительная и молочная пища. К человеку 90Sr поступает в основном с коровьим молоком и рыбой.
Биологическое действие 90Sr связано с характером его распределения (накопление в скелете) и зависит от дозы β -излучения, создаваемой им и его дочерним радиоизотопом иттрием 90Y. 90Sr накапливается в костных тканях живых организмов, замещая Ca, что ведет к хрупкости костей и другим вредным воздействиям на организм, поэтому актуальна проблема очистки от него сточных вод АЭС. При длительном поступлении 90Sr в организм, даже в относительно небольших количествах, в результате непрерывного облучения костной ткани могут развиться лейкемия и рак костей. Помимо лейкозов и остеосарком, 90Sr вызывает также рак молочных желез [21, 23, 54].
Стронций-90, наряду с цезием-137, являются основными загрязняющими радионуклидами на территории России. Заключение в 1963 г. в Москве договора о запрещении испытаний ядерного оружия в атмосфере, космосе и под водой привели к почти полному освобождению атмосферы от 90Sr и уменьшению его подвижных форм в почве. Пока не были запрещены испытания атомного и водородного оружия в трех средах, число пострадавших от стронция росло из года в год.