
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задания для самостоятельной работы на занятии
|
|
БУФЕРНЫЕ СИСТЕМЫ КРОВИ
Цель занятия.
Рассмотреть буферные системы крови, их роль, механизм действия. Расширить знания о кислотно-основном равновесии в организме. Научиться рассчитывать и готовить буферные ряды, экспериментально исследовать свойства буферных растворов и буферное действие сыворотки крови.
Сформировать представление о механизме действия буферных систем организма и их роли в поддержании кислотно-основного баланса
Исходный уровень знаний
1. Знание состава, свойств, механизма буферных систем.
2. Знание формул расчета рН в буферных растворах.
3. Знание понятия буферной емкости, ее расчет.
4. Умение обращаться со стеклянной мерной посудой.
5. Умение рассчитывать рН буферных растворов и их емкости.
После изучения темы студент должен:
— знать:
– состав буферных систем крови;
– механизм их действия;
– взаимосвязь и соотношение буферных систем в организме;
- ацидоз и алкалоз как патологические состояния, их причины и виды.
— уметь:
- применять теоретический материал к рассмотрению буферных систем в биологических объектах;
– доказывать на практике, что сыворотка крови обладает буферным действием.
Учебно-целевые вопросы:
1. рН биологических жидкостей.
2. Буферные системы крови:
– основные буферные системы крови;
– состав буферных систем;
– взаимосвязь и соотношение буферных систем в организме;
– механизм буферного действия;
– роль буферных систем в процессе жизнедеятельности организма;
– понятие о щелочном резерве крови (ацидоз, алкалоз).
3. Сравнительная величина емкости буферных систем организма.
4. Особенности действия гемогаобиновой буферной системы. Связь с процессом оксигенации.
5. Совместное действие буферных систем организма.
Вопросы и задания для самоподготовки
(обязательные домашние задания, выполняемые в отдельной тетради)
Основные буферные системы крови
Соотношение буферных систем в организме
Роль буферных систем в живых организмах
Щелочной резерв крови
Буферная кривая
Какая буферная система вносит максимальный вклад в буферную емкость крови?
Какое соотношение СО2 и НСО3– опасно для жизни?
Механизм протеинового буфера
Зачем в организме создается резерв СО2?
10. При заболеваниях, связанных с нарушением дыхательной функции легких (бронхите, воспалении легких и т.п.), приводящим к увеличению содержания СО2 в легких, наблюдается:
1) дыхательный ацидоз 2) дыхательный алкалоз
11. Респираторный (дыхательный) алкалоз наблюдается при:
1) гиповентиляции легких 2) гипервентиляции легких
12. Убольных сахарным диабетом за счет накопления в организме β -гидроксимасляной кислоты развивается:
1) метаболический алкалоз 2) респираторный алкалоз
3) метаболический ацидоз 4) респираторный ацидоз
13. При интенсивной физической нагрузке развивается метаболический ацидоз. Какой режим дыхания можно рекомендовать спринтеру перед началом бега для предварительной компенсации метаболического ацидоза?
1) гиповентиляцию легких 2) гипервентиляцию легких
14. При гипотермии температуру в организме понижают до 24°С. (в этом режиме проводятся операции при патологии кровообращения). Значение рН = 7, 36 будет в этом случае:
1) ацидозом 2) алкалозом
15. При гипервентилянии легких наблюдается:
1) ацидоз, рН мочи уменьшается 2) ацидоз, рН мочи увеличивается
3) алкалоз. рН мочи уменьшается 4) алкалоз, рН мочи увеличивается
Задания для самоконтроля (включены в коллоквиум и зачетное занятие)
1. Укажите гемоглобиновую буферную систему:
1) HCOO-, HCOOH 2) HCO3-, H2CO3 3) Hb-, HHb, HbO2-, HHbO2 4) CH3COO-, CH3COOH
2. В плазме крови (рН=7, 36 – 7, 42) отсутствует буфер:
1) белковый 2) аммиачный 3) фосфатный 4) бикарбонатный
3. При физиологическом значении рН=7, 36 соотношение [ HCO3- ] / [ CO2 ] равно:
1) 20: 1 2) 15: 3 3) 10.7: 1 4) 4: 1
4. При физиологическом значении рН=7, 36 соотношение [ HPO42- ] / [ H2PO4- ] равно:
1) 20: 1 2) 10: 1 3) 16: 3 4) 4: 1
5. Щелочной резерв крови – это:
1) число мл СО2 в 100 мл крови 2) число мл NaOH при титровании 3) ацидоз 4) алкалоз
6. Какой вид имеет уравнение Гендерсона – Гассельбаха для бикарбонатной буферной системы в крови человека:
1) рН = рКа + lg 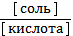 2) рН = 6, 11 + lg
2) рН = 6, 11 + lg 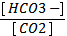
3) рН = 14 - рКосн - lg  4) рОН = рКосн - lg
4) рОН = рКосн - lg 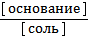
7. Буферное действие белков связано:
1) с их амфотерными свойствами 2) с образованием катионов
3) с образованием анионов 4) с образованием биполярного иона
8. Экстренная мера при ацидозе:
1) Na2SO4 2) 4, 5 – 8, 4%NaHCO3 3) NH4CH3COO 4) NH4CI
9. Кислотно–основное состояние организма связано главным образом с:
1) бикарбонатной буферной системой 2) фосфатной буферной системой
3) белковой буферной системой 4) аммиачной буферной системой
10. Для устранения алкалоза вводят:
1) 5% р-р аскорбиновой кислоты 2) соляную кислоту 3) гидрокарбонат натрия 4) ацетат аммония
11. Смещение рН крови в кислую область – это:
1) алкалоз 2) ацидоз 3) ацидиметрия 4) алкалиметрия
12. Увеличение щелочных продуктов в плазме крови концентрацию СО2:
1) увеличивает 2) уменьшает 3) не изменяет 4) сперва рост, потом уменьшение
13. Фосфатная буферная система действует в:
1) плазме крови 2) плазме крови и во внутренней среде эритроцитов
3) во внутренней среде эритроцитов 4) во внеклеточной жидкости
14. рН крови в норме:
1) 6, 80 – 6, 90 2) 7, 90 – 8, 02 3) 7, 36 – 7, 42 4) 7, 52 – 7, 82
15. Какой анион HPO42- соли Н2РО4- принимает участие в нейтрализации протонов в почечной ткани:
1) Н2РО4- 2) HPO42- 3) оба аниона в одинаковой степени 4) анионы не принимают участие
Задания для самостоятельной работы на занятии
1. Какая буферная система вносит максимальный вклад в буферную емкость крови?
2. Механизм белкового буфера;
3. Как изменяется рН при выдохе?
4. Активная кислотность желудочного сока 0.047. Рассчитать рН желудочного сока.
Ответ: рН= 1.33
5. Определить рН раствора, содержащего 0.1 моля эфедрин-основания и 0.01 моля эфедрин-гидрохлорида в 1 л раствора, если рКэфедрина = 4.64.
Ответ: рН= 10.36
6. Каково соотношение бикарбоната и угольной кислоты в крови, рН которой 7.40, если суммарный рК в крови 6.11?
Ответ: 19.5: 1
7. Определить буферную емкость крови, если для изменения ее рН от 7.36 до 7.00 добавили к 1.00 мл крови 3.6 мл 0.05 н соляной кислоты.
Ответ: 0.5 моль-экв
8. Во сколько раз концентрация водородных ионов в крови (рН 7, 36) больше, чем в спинномозговой жидкости (рН 7.53)?
Ответ: в 1.48 раз
9. Зачем в организме создается резерв СО2?
10. Что такое алкалоз, ацидоз?
11. Зачем нужна буферная кривая?
12. Какое соотношение СО2 и НСО3- опасно для жизни?
13. При неудержимой рвоте в организме возникает метаболический алкалоз за счет потери кислотных компонентов желудочного сока. Какой режим дыхания следует рекомендовать в этом случае?
14. Каково соотношение бикарбоната натрия и угольной кислоты в крови, рН которой = 7.40, если суммарный рК в крови 6.11?
Ответ: 19.5: 1.
15. Определить буферную емкость крови, если для изменения ее рН от 7.36 до 7.00 добавили к 1.00 мл крови 3.6 мл 0.05 н соляной кислоты.
Ответ: 0.5 моль-экв.
|