
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема 1. Последов ателье ость атшгоа ври биохимических исследованиях Эош ассмюив» 06wt ятоаедоюм 6 страница
|
|
Альбумины — белки относительно небольшой молекулярной массы (15— 70 тыс.); они имеют избыточный отрицательный заряд и кислые свойства (изоэлектрическая точка 4, 7) из-за большого содержания глутаминовой кислоты. Это сильно гидратированные белки, поэтому они осаждаются только при большой концентрации водоотнимающнх веществ. Характерным (двойством альбуминов является высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы. Благодаря высокой неспецифической адсорбции различных веществ альбумины плазмы крови играют физиологически важную транспортную роль.
Глобулины — белки с большей, чем альбумины, моленулярной массой (свыше 100 000). В отличие от альбуминов они нерастворимы в чистой воде; растворимы в слабых солевых растворах. Глобулины — слабокислые или нейтральные белки (изоэлектрическая точка лежит в интервале рН6 — 7, 3); содержат меньше, чем альбумины, кнслых аминокислот, Это слабогидрати- рованвые белки, поэтому и осаждаются они в менее концентрированных растворах сульфата аммония. Некоторые из глобулинов обладают способностью к специфическому связыванию веществ (специфические переносчики), другие, как и альбумины, к неспецифическому связыванию липидораствори- мых веществ.
При электрофорезе происходит разделение альбуминов и глобулинов, поскольку оян обладают разной подвижностью в электрическом поле. Альбумины как полианионные белки быстрее движутся к аноду, чем глобулины. Поэтому при электрофорезе, например белков сыворотки крови или других биологических жидкостей, на бумаге или других поддерживающих средах белки в зависимости от их подвижности распределяются на фракции (зоны). Глобулины делятся на три главные электрофоретические фракции: a-, JJ- и угл°булины. Среди а-глобулинов выделяют а, - и а2-глобулины; среди (3-глобулинов — р, - и р2-глобулины; фракция у-глобулииоа представлена смесью различных иммуноглобулинов.
Электрофорез на бумаге позволяет получить до 5 главных зон белков сывортки крови (альбумины, сц-, а2-, р- и у-глобулины). Высокую степень разрешения имеет электрофорез в полнакрнламидном геле, дающий возможность выявить до 17 электрофоретических полос разных белков всех главных зон (альбуминов, о, -, Oj-, (Зг, и у-глобулинов). При электрофорезе внутриклеточных белков или других жидкостей организма разделение белков происходит по тем же зонам подвижности, что и белков сыворотки крови. Но это не значит, что здесь присутствуют белки с той же функцией, что и в сыворотке крови, хотя электрофоретическая картина их сходна. Поэтому белки сыворотки крови часто используют в качестве стандарта для сравнения с белками, выделенными из разных тканей и жидкостей (при этом говорят, что такой-то неизвестный белок обладает, например, подвижностью а, -глобулина или альбумина и т. д.).
Протеиноиды — белки опорных тканей (костей, хрящей, связок и сухожилий, ногтей, волос н т. д.). Все они относятся к фибриллярным белкам (фиброин, коллаген, кератин, эластин). Они растворимы только в специальных растворителях. Строение и физико-химические свойства этих фибриллярных белков рассмотрены ранее.
Все перечисленное простые белки, строго говоря, не являются простыми. Пожалуй, лишь для гистонов и протаминов применимо это название, да и то с известными оговорками, поскольку в природных условиях они образуют прочные комплексы с ДНК. В остальных белках обнаружены неаминокислотные компоненты (углеводы, липиды, металлы и др.). По этой причине их нельзя назвать простыми. Кроме того, есть большая группа белков, которые ведут себя как альбумины (растворимы в воде), а высаливаются как глобулины. Их называют псевдоглобулинами.
Сложные белки, или белок-небелковые комплексы, являющиеся разновидностью смешанных макромолекул, целесообразно рассматривать после знакомства со структурой и свойствами входящих в них небелковых компонентов — углеводов, липидов, полинуклеотидов и т, д.
7. Биологические функции белков
Биологические функции белков столь разнообразны (см. табл. 12), что трудно назвать процессы, а которых белки не принимают участия. Лишь генетическая функция принадлежит не белкам, а нуклеиновым кислотам, структура которых приспособлена для записи и воспроизведения генетической программы.
Таблица 12. Биологические функции белков и их характеристика
Характеристика функций белков
Одна из наиболее распространенных функций белков, которая состоит а ускорении химических превращений (сиител и распад веществ; перенос отдельных групп атомов, электронов от одного вешества к другому) Регуляция обмена веществ внутри клеток и интеграция пЛм«на в разных клетках целого организма
Избирательное связывание различных регуляторов (гормонов, медиаторов, циклических нунлеотидов) на поверхности клеточных мембран или внутри клетки (цитоаольяые рецеп-
Учествуют в построении различных мембран
Близкая по назначению и структурной, Обеспечивает прочность опорных тканей, участвуя в построении внеклеточных структур
Использование белков нак запасно- матернзла для питании развивающихся клеток
Близка к резервной. Белок исполь- •зустся как субстрат (при распаде) для образования анергии. При распаде I г белка выделяется 17, 1 кДж энергии
Сокращение (механический процесс) использованием химической энер-
1 Участиз в обравованнн разницы | электрических зарядов и градиента.
Фумаратгидратаза — катализирует обратимое превращение фумарат + +" НаО-*малат
Цигохрояоксидаэа — участвует в трансаорте электронов на кислород
Инсулин — участвует в регуляции
других обменов
ЛкТгропин — участвует а регуляции синтеза прогестерона в желтом теле
Цитоэольный рецептор зет радиола — связывает эстрад иол внутри клеток, например слизистой матки Глюкагонаеый рецептор — связывеет гормон глюхагон на поверхности Клеточной мембраны, например печени Регуляторная субъединица протеин- киназы — связывает цАМФ внутри
Транскортин — переносит кортнко- стерояды (гормоны коры надпочечников в крови)
Миоглобин — перекосит кислород в мышечной ткани
Структурные белки митохондрий, плазматической мембраны к т. д. Коллаген — структурный элемент опорного каркаса костной ткани, сухожилий
Фиброин — участвует, в построении оболочки кокона шалкопряда ф-Кератин — структурная основа шерсти, ногтей, копыт
Проломаны и глютелины — вапасной матери ил семян пшеницы Овальбумин — запасной белок куриного яйца (используется при развитии зародыша)
Все белки (поступающие или с пищей, клн внутри плеточные), которые распадаются до конечных продуктов (СО„ НгО, мочевина)
Миозин — закрепленные ннтн в мио- фнбриалах
Актин — движущиеся а кг и в мно- фибрнллах
Na+, К+АТФаза — фермент, участвующий в создании разницы кон-
Трансформация электрической и осмотической энергии в химическую энергию (АТФ)
Вспомогательная генетическая фувк цня белков (приставка «ко» в переводе с латинского оеначает совместность действия). Саки белки ие являются ген^ическнм (наследственным) материалом, но помогают нуклеиновым кислотам р еа лнэовы вать способность к самовоспроизведению н переносу информации Способность некоторых белков участвовать в регуляции матричных функций нуклеиновых кислот н переноса генетической информации
Антитела участвуют в обезвреживании чужеродных антигенов микроорганизмов (токсинов, выделяемых ими) путем образования комплекса антиген —антитело Некоторые белки и пептиды, выделяемые организмами (в основном микроорганизмами), яэляются ядовитыми для других живых органнэ-
| Характеристика функций белков |
Благодаря функциональным группам белки связывают токсические соединения (тяжелые мсткллы, алкалоиды), обезвреживая их Участвуют в образовании тромба и кровотечения центрацнй ионов Na+ и К* и электрического заряда на клеточной мемб-
| Продолжение табл. 12 |
АТФ-синтетаза — осуществляет синтез АТФ за счет разности электрических потенциалов или градиента осмотической донцентрацни иоиоа на сопрягающей мембране
вующнй в репликации ДНК ДНК-зависимая РНК-полимераза — фермент, участвующий в переносе информации от ДНК к РНК
Гистоны — белки, участвующие в регуляции репликации и частично транскрипции участков ДНК Кислые белки — участвуют в регуляции процесса транскрипции отдельных участков ДНК Иммуноглобулины А, М, G и др. — выполняют защитную функцию Комплемент — белок, саособствующий образованию комплекса ' антиген —
Фибриноген — белок сыворотки крови. полимеризуется в виде сетки, составляющей структурную основ > тромба
ГЛАВА 4. УГЛЕВОДЫ
Углеводы наряду с белками — наиболее распространенные соединения, участвующие в построении клетки и используемые в' процессе fee жизнедеятельности.
Углеводами (сахарами) называют полиоксикарбоиильные соединения и их производные. Термин «углеводы» устарел и не отражает ни химической природы, ни состава этих соединений, однако предложенный для них термин «глициды» не.получил распространения. Характерным отличительным признаком углеводов является наличие не менее двух гидроксиль- ных групп и карбонильной (альдегидной или кетоиной) группы. Следова-
н, с — он
диг идрохсиацетон
Углеводы, имеющие альдегидную группу, называют альдозами, а кетон- ную — кетозами.
Классификация углеводов основана на их структуре (схема 3) и физико- химических свойствах.
Схема 3. Структурная классификация углеводов Угл»мим (старты) |
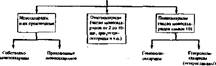
| Тршпы (С-31 " Г прозы (С-4) Ленты (С-51 Гексозы (С-61 |
| ♦ Глихоэщы (нуклеомды, иуклеотипы. |
| Октозы (C-8) Коноэы (С-9) . ДекоЗы (С-101 |
| 6-фосфи, бясфосфп'к и |
По физико-химическим свойствам углеводы делят на нейтральные, содержащие только гидроксильНые и карбонильные группы; основные, включающие кроме названных аминогруппу (аминосахара); кислые, содержащие кроме гидроксильных и карбонильных групп карбоксильные группы.
I, Моносахариды
Моносахариды, или монозы, — это простейшие углеводы. В названии всех моносахаридов имеется окончание -оза. Групповое наименование моносахаридов складывается из числа углеродных атомов и наличия соответствующей карбонильной группы — альдегидной или кетонной. Например, моносахариды, имеющие пять углеродных атомов, называют пентозами, а с учетом альдегидной группы — альдопептозами; если же они содержат кето-
группу, то кетопентозами. Углеводы с шестью углеродными атомами называют соответственно альдогексозами и кетогексозами.
Разные моносахариды принадлежат- к соединениям L- или D-ряда в зависимости бт L- или D-конфигурации заместителей у асимметрического атома углерода данного моносахарида, который дальше всего.отстоит от карбонильной группы. Например, у гексоз это С-5.'
В водном растворе моносахариды существуют в виде или развернутой цепи, или циклической структуры. Циклические моносахариды отсутствуют у триоз и тетроз, но, начиная с пентоз, происходит самопроизвольная реакция между одной из гидроксильных групп и карбонильной группой с образованием цикла. Так образуются, например, пятичленные (фураноз- ные) и шестичленные (пиранозные) циклы. Гидроксил у первого углеродного атома циклического моносахарида называют полуацетальным. От него зависят восстанавливающие свойства углеводов.
Производные моносахаридов. Модификация имеющихся групп или введение новых заместителей в молекулу дает различные производные моносахаридов. Они используются для построения разнообразных' полимерных углеводов. Некоторые из производных являются промежуточными продуктами обмена.
Ниже приведены некоторые представители производных моносахаридов:
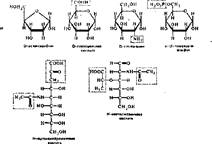
|
| нон, с но он ic'OOHi " Г. н—с—он »о4-н н—с—он н—с—он соон |
2-Дезокси-Р-рибоза (или просто дезоксирибоза) входит в состав дезоксири- бпнуклеоаидов и дезоксирибонуклеотидов, являющихся структурными мономерами ДНК.
Многие моносахариды участвуют в синтезе важной группы соединений — гликозидов. В частности! рибоза и дезоксирибоза входят в состав
упомянутых нуклеозидов и нуклеотидов, являющихся N-гликозидами (см. «Нуклеиновые кислоты»).
Окисление спиртовой группы до карбоксильной приводит к образованию уроновых кислот. Среди них важную роль играют глюкуроновая, галакту- роиовая, маннуроиовая, идуроновая и другие кислоты,, которые входят в состав кислых полисахаридов, или так называемых пектиновых веществ.' Окисление двух концевых групп до карбоксильной дает аровые кислоты — глюкаровую, галактаровую и т, д., которые не имеют точно установленного биологического значения.
Важную роль играют аминосахара, или аминодеэоксисахара. D-Глю- козамин используется для построения важных структурных полисахаридов — гналуроновой кислоты, хитина и др., а D-галактозамин участвует в синтезе полисахаридов хрящевой ткани — хондроитинсульфатов и некоторых глико- липидов. Производное D-глюкозамина N-ацетилмурамовая кислота входит в состав полисахаридов клеточных мембран бактерий, а производное D- маннозамнна N-ацетнлнейраминовая, или сиаловая, 'кислота является необходимым звеном клеточных гликопротеидов и гликолнпидов тканей человека и животных.
Обширную группу производных моносахаридов составляют фосфорные афиры, которые образуются в ходе превращений углеводов в тканях.
Биологическое значение моносахаридов. В клетке моносахариды используются как источник энергии, причем моносахариды (как, впрочем, и полисахариды) в отличие от других соединений являются энергетическим субстратом клеток организма человека и животных как в присутствии кисло- рода, так и в его отсутствие. Кроме того, моносахариды и их производные участвуют в построении • самых разнообразных биологических молекул, т. е. выполняют пластическую функцию.
2. Олигосахарнды
Олигосахаридами называют углеводы, имеющие от двух до десяти звеньев моносахаридов, соединенных гликозидными связями. Они отличаются друг от друга составом моносахаридов и типом гликозндной связи.
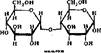
|
Среди наиболее распространенных олигосахаридов можно отметить лактозу, содержащуюся в молоке; сахарозу, чрезвычайно распространенную в растительном мире; мальтозу, являющуюся продуктом частичного гидролиза крахмала в растениях; трееалозу, присутствующую в грибаХ:

|
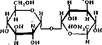
|
В клетках и биологических жидкостях олигосахариды находятся как в свободном виде, так к в составе смешанных углевод-белковых комплексов (гликопротеидах), соединяясь с белком ковалентными связями.
Биологическое значение олигосахаридов еще подробно не изучено. Как ценные пищевые вещества, используемые клетками для получения энергии после разложения их на моносахариды, они известны давно. Возможно, что олигосахариды, входящие в состав гликопротеидов клеточной мембраны, являются своеобразными «локаторами», с помощью которых клетки «узнают» друг друга.
3. Полисахариды
Полисахаридами, или гликанами, называют высокомолекулярные углеводы содержащие более десяти моносахаридных звеньев, соединенных гликозид- ными связями. Разные полисахариды отличаются природой моносахаридов молекулярной массой и типом гликозидных связей в цепях моносахаридов. Чаще всего мономером их является D-глюкоза. Но встречаются и другие моносахариды: галактоза, манноза, фруктоза, а также производные моносахаридов.
Различают гомополисахариды (гомогликаны), образованные моносахаридом одного типа, и, гетерополисахариды (гетерогликаны), состоящие из разных моносахаридов. Например, крахмал — гомополисахарид (в него входит только D-глюкоза); гиалуроновая кислота—гетерополисахарид (в нее входят чередующиеся звенья D-глюкуроновой кислоты и N-ацетил-D- глюкоза- мина).
По типу строения цепей полисахариды делят на линейные и разветвленные.