
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры
|
|
Пример 4.1. Какая масса негашеной (комовой) извести получится при обжиге т н= 10 т известняка, имеющего влажность W н= 5 %? Содержание глинистых примесей составляет 10 %, а песчаных – 10 %.
Определить выход обожженной извести, ее активность (содержание СаО). К какому сорту будет относиться полученная комовая известь. в соответствии с требованиями ГОСТ 9179-77?
Решение: Масса известняка после испарения воды
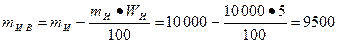 кг.
кг.
Из глинистых примесей А1203 • 2Si02 ∙ 2Н, 0 (молекулярные массы – 102 + 120 + 36 = 258) происходит удаление химически связанной воды. Ее содержание в долях от единицы составит исходя из пропорции:
36- х
258 - 1
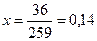
Содержание в извести глинистых примесей после испарения воды
Г = 0, 1 ∙ mи.в (1 – 0, 14) = 0, 1∙ 9500 (1 – 0, 14) = 817 кг
Содержание песчаных примесей в извести
П = 0, 1 mи.в – (Г + П) = 0, 1 ∙ 9500 = 950 кг
Масса чистого известняка CaC03
mч = mи.в - (Г + П) = 9500 – (817 + 950) 7733 кг
Реакция разложения известняка
CaC03 = СаО + C02 ↑.
Молекулярные массы веществ следующие:
100 = 56 + 44.
Масса извести, изготовленной из 1 т известняка:
И= 1000 ·  = 560 кг.
= 560 кг.
Тогда масса чистой комовой извести
Ич = mч • 0, 56 = 7733 • 0, 56 = 4330 кг.
Выход комовой извести с учетом глинистых и песчаных примесей
Ик = Ич + (Г + П) = 4330 + (817 + 950) = 6097 кг.
Активность извести (содержание СаО):
Ан = 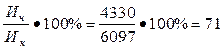 %
%
Следовательно, известь относится к третьему сорту.
Пример 4.2. Рассчитать, сколько получится негашеной и гидратной извести («пушонки») из mи = 20 т известняка. Содержание в известняке СаО — 85 % по массе, а его естественная влажность W = 8 %.
Решение: При нагревании известняка испарится воды
В =  кг (л)
кг (л)
Тогда сухого известняка останется
тс = т и - В = 20 000 - 1600 = 18 400 кг.
Количество примесей в известняке
Пи = 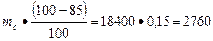 кг
кг
Тогда масса чистого известняка
т ч = т с- Пи = 18400 – 2760 = 15640 кг
Масса чистой негашеной извести, определяемой исходя из молекулярных масс следующего уравнения:
CaC03 = СаО + C02 ↑.,
100 = 56 + 44
m ч.н.и = m ч · 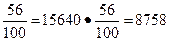 кг.
кг.
Однако примеси в количестве 2760 кг останутся в негашеной извести, тогда общая масса негашеной извести
m о.н.и = m ч.н.и + Пи = 8758 + 2760 = 11518 кг.
Из этого количества негашеной извести можно получить гидратной извести
СаО + Н2 О = Са(ОН)2
56 + 18 = 74
тогда гидратной извести будет
m г.и = m ч.н.и · 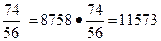 кг.
кг.
В состав гидратной извести также войдут в количестве 2760 кг, с учетом которых общая масса гидратной извести
mб. г.и = m г.и + Пи = 11573 + 2760 = 14333 кг.
Пример 4.3. Определить среднюю плотность известкового теста, если воды в нем содержится 50 % (по массе). Истинная плотность порошкообразной гидратной извести ри.и = 2050 кг/м3.
Решение: В 1 кг известкового теста содержится 500 г извести и 500 г воды.
Абсолютный объем, занимаемый известью
Vа.и = 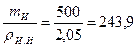 см3.
см3.
Объем воды В = 500 г = 500 см3.
Тогда абсолютный объем известкового теста
Vа.и.т = Vа.и + В = 243, 9 + 500 = 743, 9 см3.
Средняя плотность известкового теста
pс.и.т = 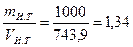 г/см3 = 1340 кг/м3.
г/см3 = 1340 кг/м3.
Пример 4.4. Сколько потребуется каменного угля с теплотворной способностью 26 380 кДж/кг, чтобы получить m н.г = 20 т негашеной извести из чистого известняка? Известно, что на разложение 1 г/моль известняка требуется 177, 9 кДж.
Решение: Для разложения 1 г/моль известняка требуется тепла исходя из уравнения
CaC03 + 177, 9 = = СаО + C02
100 + 177, 9 ккал = 56 + 44.
Следовательно, чтобы получить 20 т негашеной извести, потребуется тепла
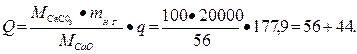
или 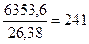 кг каменного угля.
кг каменного угля.
Пример 4.5. Рассчитать объем шахтной печи для получения m н.и = 20 т в сутки негашеной извести при условии, что средняя плотность в кусках равна pс.и = 1700 кг/м3, тоиливо занимает около 25 % общего объема печи. Цикл обжига проходит за tобж = 2 дня.
Решение: Для получения 20 т негашеной извести в сутки необходимо обжечь известняка
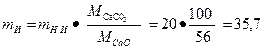 т.
т.
Тогда объем известняка
Vи =  м3.
м3.
Объем печи только для известняка
Vп = Vи · tобж = 21 · 2 = 42 м3.
С учетом объема топлива (около 25% общего объема печи)
Vп.т = Vп + 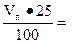 1, 25 Vп = 1, 25 · 42 = 52, 5 м3.
1, 25 Vп = 1, 25 · 42 = 52, 5 м3.
Пример 4.6. Сколько потребуется гидратной извести, чтобы приготовить 1 м3 известкового теста со средней плотностью рс = 1400 кг/м3? Истинная плотность гидратной извести рс.г = 2000 кг/м3.
. ии'ние: Содержание гидратной извести в килограммах обозначим через х. Тогда количество воды
В = 1400 - х.
Сумма абсолютных объемов извести и воды равна 1 м3, тогда
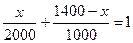 , откуда х = 800 кг.
, откуда х = 800 кг.
Таким образом, для приготовления 1 м3 известкового теста потребуется 800 кг гидратной извести Са(ОН)2.
Пример 4.7. Сколько нужно взять гидравлической добавки, чтобы полностью связать 1 часть гашеной извести, имеющей активность 80% (содержание СаО)? Установлено, что в составе гидравлической добавки имеется 60 % активного кремнезема. Предполагается, что в результате твердения будет образовано соединение СаО · Si02 · Н20 — однокальциевый гидросиликат. Решение: Молекулярные массы предполагаемого соединения
СаО • Si02 • Н20 = 56 + 60 + 18 = 134 г/моль.
На 1 часть негашеной извести требуется активного кремнезема
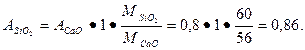
Поскольку в гидравлической добавке активный кремнезем составляет 60 %, тогда доля гидравлической добавки
Дг = ^ = ^ = 1, 43. 0, 6 0, 60
Следовательно, состав смеси извести и гидравлической добавки по массе будет 1: 1, 43.
Пример 4.8. Какой объем известкового теста будет при гашении т н.и= 10 т негашеной извести, если активность извести Аи (содержание СаО) 80 %, содержание воды в тесте 50 %, средняя плотность известкового теста рс.т = 1400 кг/м3.
Решение: Образование гашеной извести происходит по реакции
СаО + Н20 = Са(ОН)2.
Молекулярные массы веществ
56 + 18 = 74 г/моль.
При указанной активности извести масса гидроксида кальция
т г.к = т н.и · 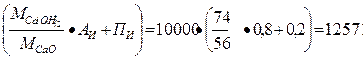 кг,
кг,
где т н.и — масса негашеной извести, кг; Аи — активность извести; Пи — содержание примесей в извести.
В известковом тесте известь и вода составляют по 50 % массы.
Тогда масса теста
т т = т г.к · 2 = 12 571 • 2 = 25 142 кг,
а его объем
Vт = 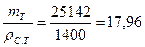 м3.
м3.
Пример 4.9. Определить количество связанной воды в процентах при полной гидратации т п.г = 1т полуводного гипса.
Решение: В 1000 кг полуводного гипса CaS04 · 0, 5Н2О (молекулярная масса 40 + 32 + 64 + 1 + 8 = 145) имеется воды 0, 5Н2О (молекулярная масса 1 + 8 = 9).
Тогда из условия
145- 1000
9 – х
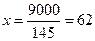 л или 62 кг.
л или 62 кг.
Для образования двуводного гипса воды потребуется дополнительно 1, 5 Н2О или 62 ·· 3 = 186 л или 186 кг
Тогда масса полностью гидратированного гипса
т г.г =т п.г+ Вд.г = 1000+ 186= 1186 кг.
Количество воды в двуводном гипсе
В'д.г= Вд.г +Вп.г = 186 + 62 = 248 л или 248кг,
что составляет
1186— 100 %
248 — х
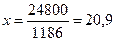 %.
%.
Пример 4.10. Нормальная густота гипсового теста равна 59 %.
Сколько необходимо взять гипса и воды для получения т г.т = 10 кг гипсового теста нормальной густоты?
Решение: Если обозначить через х необходимое количество гипса,. то масса воды составит 0, 59 х.
В сумме должно быть 10 кг, т.е.
х + 0, 59 х = 10.
Тогда масса гипса х = 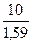 = 6, 3 кг
= 6, 3 кг
Воды необходимо
В = mг.т - mг = 10 - 6, 3 = 3, 7 кг.
Пример 4.11. Для затвердения т г - 5 кг строительного гипса взято 65 % воды.
Определить пористость полученной абсолютно сухой гипсовой отливки при условии, что весь гипс состоял из полугидрата, а средняя плотность сырой отливки равна рс.г.о = 2, 1 г/см3.
Решение: Масса воды затворения
т в.з = 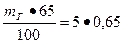 = 3, 25 кг.
= 3, 25 кг.
Масса сырой отливки
т г.о = т г + т в= 5 + 3, 25 = 8, 25 кг = 8250 г.
Тогда объем отливки (сырой)
Vг.о = 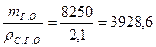 см3.
см3.
Определяем массу воды, вступившей в химическую реакцию, по уравнению и исходя из молекулярных масс входящих веществ:
CaS04 · 0, 5Н2О + 1, 5Н20 = CaS04 · 2Н20.
145 27
Составив пропорцию
145 – 27
5 - х,
находим
х = т в =  кг.
кг.
Осталось несвязанной воды
т в.н = т в.з - т в= 3, 25 -0, 93 = 2, 32 кг = 2320 г.
При испарении этой воды образуются поры общим объемом Vn = т вн = 2320 см3, поэтому пористость гипсовой отливки
Пг.о = 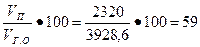 %.
%.
Пример 4.12. При испытании гипсового вяжущего вещества было установлено: тонкость помола — остаток на сите № 02 — 10 % (по массе), предел прочности при сжатии трех образцов через 2 ч после изготовления — 5, 2; 4, 8 и 5, 0 МПа.
К какой марке можно отнести гипсовое вяжущее вещество?
Решение: Согласно ГОСТ 26871-86 гипсовое вяжущее вещество имеет марку Г-5-П, так как требования к тонкости помола для второй группы: остаток на сите № 02 (918 отв/см2) должен быть не больше 14 %.
Предел прочности при сжатии для этого гипса — 5, 0 МПа, а согласно указанному стандарту для гипса марки Г-5 в возрасте 2 ч он должен быть не меньше 5, 0 МПа.
Пример 4.13. Определить пористость затвердевшего гипсового вяжущего, если водогипсовое отношение В/Г = 0, 7. Истинная плотность гипса ри.г= 2, 7 г/см3.
Решение: Для определения пористости затвердевшего гипса определим его истинную и среднюю плотности.
Истинная плотность затвердевшего гипса
pи = 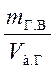 ,
,
где mг.в – суммарная масса гипса и химически связанной воды в единице абсолютного объема Vз.г.
Содержание химически связанной воды Вс.в легко найти из уравнения гидратации основного компонента строительного гипса CaS04 · 0, 5Н2О
CaS04 · 0, 5Н2О + 1, 5 Н2О = CaS04 · 2 Н2О.
145 27
Исходя из пропорции
145 - 100
27 - х (Вс.в),
Вс.в = 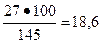 %.
%. 
Предположим, что плотность химически связанной воды pв = 1 г/см3, тогда


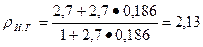 г/см3.
г/см3.
Средняя плотность затвердения гипса
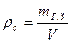 ,
,
где V – объем с учетом пор, образовавшихся избыточной водой
 г/см3.
г/см3.
Пористость затвердевшего гипса
Пг =  %.
%.
Пример 4.14. Сколько потребуется кремнефтористого натрия для связывания mж.с = 10 кг жидкого стекла? Содержание в жидком стекле Nа2О – 12 %, а SiО2 – 30, 8 %.
Решение: Требуемое количество Na2SiF6 (% от жидкого стекла) для натриевого стекла можно установить по формуле
х = 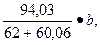
где b = Na20 + Si02 — содержание окиси натрия и кремнезема в жидком стекле, %.
Тогда
х = 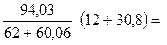
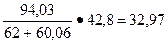 %.
%.
В количественном отношении кремнефтористого натрия потребуется 3, 297 кг.
Пример 4.15. Сколько тонн каустического магнезита можно получить при обжиге т м = 15т природного магнезита, содержащего 8 % (по массе) неразлагающихся примесей?
Решение: Масса чистого магнезита
т ч.м= т м(1 - 0, 08) = т м• 0, 92 = 15 • 0, 92 = 13, 8 т.
Тогда примесей
т п = т м – т ч.м=15- 13, 8 = 1, 2 т.
При обжиге магнезита происходит следующая реакция:
MgC03 = MgO + C02 ↑,
84 40
где внизу проставлены молекулярные массы веществ, отсюда
84 - 40
13, 8 - х
х = т MgO = 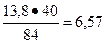 т.
т.
Вместе с примесями масса каустического магнезита
т к.м = т MgO + т п = 6, 57 + 1, 2 = 7, 77 т.
Пример 4.16. Для получения магнезиального вяжущего вещества расходуется (по массе) 65 % чистого каустического магнезита (MgO) и 35 % MgCl2 · 6 Н2О.
Сколько необходимо взять каустического магнезита, содержащего 85 % активной MgO, и сколько литров водного раствора MgCl2, содержащего 410 г MgCl2 • 6Н2О в одном литре, чтобы получить 50 кг магнезиального вяжущего вещества (в расчете на чистые компоненты)?
Решение: Определяем, сколько MgO и MgCl2 · 6Н2О должно и содержаться в 50 кг вяжущего вещества.
Массу MgO определим из пропорции
50 кг - 100 %
χ MgO кг – 65
Тогда
χ MgO = 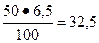 кг.
кг.
Количественно
MgCl2 · 6Н2О = 50 - 32, 5 - 17, 5 кг.
Чтобы обеспечить массу чистой MgO, которой содержится 85 % каустическом магнезите, необходимо взять указанного магнезита
mк.м = 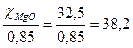 кг,
кг,
а. водного раствора MgCl2 , содержащего 410 г MgCl, 2 • 6Н2 О, необходимо взять
т а.р = 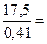 42, 7 л.
42, 7 л.
Пример 4.17. Определить массу раствора хлористого магния и его истинную плотность для затворения магнезита с содержанием MgO — 85 %. Для получения теста на основе магнезита требуется 52 % воды по массе. Предполагаем, что весь свободный магнезит вступает в реакцию с хлористым магнием, образуя • 3MgO • MgCl2 • 6Н2О.
Средняя плотность хлористого магния 1, 6 г/см3.
Решение: Молекулярная масса соединения
3MgO • MgCl2 • 6Н2О
121 +95, 3 + 108.
Тогда на 1, 0 кг магнезита требуется хлористого магния
т х.м = т м · 0, 85 ·  кг.
кг.
Для получения магнезитового теста из 1 кг магнезита требуется воды
т в = т м · 0, 52 = 1, 0 • 0, 52 = 0, 521 или 0, 52 кг.
Масса раствора хлористого магния
т р.х.м= т х.м + т в = 1, 43 + 0, 52= 1, 95 кг.
На единицу магнезита (1, 0 кг) объем раствора хлористого магния
Vр.х.м = 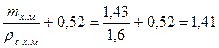 дм3.
дм3.
Средняя плотность раствора хлористого магния
pс.р.х.м = 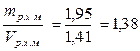 кг/дм3 = 1, 38 г/см3.
кг/дм3 = 1, 38 г/см3.
Пример 4.18. Сколько следует добавить трепела к портландцементу М 600, чтобы получить пуццолановый портландцемент М 400? Предполагается, что трепел не участвует в реакции образования цементного камня до 28-суточного возраста.
Решение: Для получения пуццоланового портландцемента М 400 необходимо добавить следующее количество компонентов к портландцементу М 600:
клинкера Кл =  • 100 - 66, 7 %;
• 100 - 66, 7 %;
трепела Тр = 100 - Кл = 100 - 66, 7 = 33, 3 %.
Пример 4.19. Даны два вида портландцемента одинаковой тонкости помола следующего минералогического состава (без добавок):
| № цемента | Минералогический состав, % | |||
| ЗСаО • Si02 (C3S) | 2СаО • Si02 (C2S) | ЗСаО • А1203 (С3А) | 4СаО · А1203 • Fe203 (C4AF) | |
| 12 10 |
Необходимо привести характеристику основных свойств портландцементов и составить рекомендации об областях их рационального применения в строительстве.
Решение: Цемент № 1 по минералогическому составу является алюминатно-алитовым, поэтому следует ожидать, что он будет быстротвердеющим, высокопрочным и высокоэкзотермичным. При термообработке бетонов на этом цементе следует ожидать значительного недобора прочности по сравнению с прочностью бетона при нормальном твердении (через 28 суток).
Исходя из этого, цемент № 1 рекомендуется применять для бетонов немассивных конструкций, где необходим быстрый рост прочности в нормальных условиях твердения, а также для конструкций, бетонируемых в зимних условиях. Для бетона массивных конструкций, а также подвергаемых теплообработке цемент.№ 1 применять не рекомендуется.
Цемент № 2 является белитовым, поэтому характеризуется замедленным твердением (особенно в ранние сроки), значительно более низкой экзотермией и весьма эффективным твердением при теплообработке.
Этот цемент, наоборот, рекомендуется применять для массивных бетонных конструкций, а также для пропариваемого сборного жеелезобетона.
Пример 4.20. Какое количество Са(ОН)2 выделится при полной идратации 1 кг портландцемента, содержащего 95 % клинкера? Содержание основных минералов в клинкере, %: C3S — 57; C2S — 22; С3А — 7; C4AF — 11. Какое количество добавки трепела с содержанием Si02 = 72 % необходимо для полного связывания выделяемого Са(ОН)2?
Решение: Выделение гидроксида кальция идет в основном в результате гидролиза при гидратации C3S. Наиболее вероятная при обычных условиях схема гидратации ЗСаО • Si02 (C3S):
2(ЗСаО • Si02) + 6H20 = ЗСаО ·ЗН20 + ЗСа(ОН)2.
Молекулярные массы
2(ЗСаО · Si02) = 2(120 + 48 + 28 + 32) = 456 г/моль,
ЗСа(ОН)2 = 120 + 102 = 222 г/моль.
Тогда количество выделяемого Са(ОН)2 при гидратации можно найти из пропорций
456 г (ЗСаО · Si02) - 222 г [Са(ОН)2]
0, 95 · 0, 57 · 1000 г - х г.
Отсюда
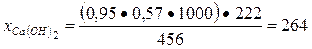 г.
г.
При взаимодействии Са(ОН)2 с кремнеземом трепела можно предположить образование однокальциевого гидросиликата
СаО · Si02 · Н20.
Для связывания 1 моля, т. е. 74 г Са(ОН)2, требуется 1 моль, т. е. 60 г Si02, а для 264 г Са(ОН)2 — х г Si02.
Тогда
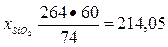 г.
г.
Для полного связывания выделяемого Са(ОН)2, при гидратации 1 кг портландцемента необходимо трепела
Тр =  г.
г.
Пример 4.21. Указать конечные продукты клинкерных минералов при гидролизе и гидратации портландцемента и определить содержание химически связанной воды для цементного камня, приготовленного из портландцемента, имеющего следующий минералогический состав: ЗСаО · SiO, (C3S) — 50 %, 2СаО · Si02 (C, S) — 25 %, ЗСаО • А1203 (С3А) — 5 %, 4СаО · А1203 · Fe203 (C4AF) — 18 %.
Решение: Условно принимаем, что в процессе твердения порт-ландцементного клинкера происходят следующие реакции:
1. ЗСаО • Si02 + 5Н2О = 2СаО · Si02 • 4H2О + Са(ОН)2;
2. 2СаО • Si02 + 2Н2О = 2СаО · Si02 · 2Н20;
3. ЗСаО • А1203 + 6Н20 = ЗСаО • А1203 · 6Н20;
4. 4СаО • А1203 • Fe203 + 2Н20 = СаО • Fe203 • 2Н, 0 + ЗСаО • А12О3• Н20.
Процентное содержание воды в каждом соединении с учетом молекулярных масс входящих веществ будет составлять:
1. Для ЗСаО • Si02 + 5Н2О:
3(40 + 16) + (28+ 32)+ 5(2+ 16) = 318; 5(2+ 16) = 90;
В = 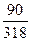 · 100 = 28, 3 %
· 100 = 28, 3 %
2. Для 2СаО • Si02 + 2Н2О:
2(40 + 16) + (28 + 32) + 2(2 + 16) = 208; 2(2 + 16) = 36;
В = 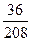 · 100 = 17, 3%.
· 100 = 17, 3%.
3. Для ЗСаО • А12О3 + 6Н20
3(40 + 16) + (53, 94 + 48) + 6(2 + 16) = 378; 6(2 + 16) = 108;
В = 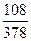 · 100 = 28, 5 %.
· 100 = 28, 5 %.
4. Для 4СаО • А1203 • Fe203 + 2Н20:
4(40 + 16) + (53, 94 + 48) + (111, 68 + 48) + 2(2 + 16) = 633;
2(2 + 16) = 36;
В =  ·100 = 5, 68 %.
·100 = 5, 68 %.
Количество воды для твердения данного состава цемента:
1. Для C3S = 50 %; В1 = 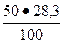 = 14, 15 %;
= 14, 15 %;
2. Для C2S = 25 %; В2 = 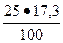 = 4, 3 %;
= 4, 3 %;
3. Для С3А = 5 %; В3 = 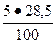 = 1, 4 %;
= 1, 4 %;
4. Для C4AF = 18 %; В4 = 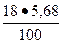 = 1, 02 %.
= 1, 02 %.
Всего воды В = В1 + В2 + В3 + В4 = 14, 15 + 4, 3 + 1, 4 + 1, 02 = = 20, 87 или 21 %.
При затворении цемента воды для получения пластичного цементного теста потребуется больше.
Пример 4.22. Для производства портландцемента имеем известняк и глину следующего химического состава:
| Наименование | СаО | MgO | Si02 | Аl2 O3 | Fe2O3 |
| Известняк Глина | 48 6 | 5 1 | 1 10 | 0, 7 6 |
Подсчитать, в какой пропорции должны быть взяты известняк и глина, чтобы получить портландцемент с коэффициентом насыщения 0, 90
Кн = 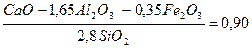
Объяснить, почему сумма соединений в составе сырья не равна 100 %.
Решение: Соотношение глины к известняку обозначим через 1: х, тогда получим
Кн = 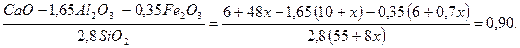
Решая данное уравнение, получим х = 5, 8.
Соотношение глины к известняку будет 1: 5, 8.
Сумма соединений в составе сырья не равна 100 %, поскольку соединения, приведенные в таблице, даны в виде оксидов, а в природе эти соединения встречаются в виде углекислых или водных соединений.
Пример 4.23. Определить активность цемента, состоящего из 70 % портландцемента марки М 400 и 30 % молотого известняка. Молотый известняк является добавкой-наполнителем.
Решение: Активность смешанного цемента
R см = 0, 7 R = 0, 7 · 400 - 280 МПа.
Пример 4.24. Рассчитать, в каком соотношении следует смешать портландцемент и кремнеземистые отходы, содержащие 22 % активного кремнезема, чтобы он соединился со свободной известью полностью и образовался однокальциевый гидросиликат. Содержание трехкалкциевого силиката в портландцементе составляет 56 %.
Решение: При гидролизе трехкальциевого силиката по реакции
ЗСаО • Si02 + 5Н20 = 2СаО • Si02 • 4Н20 + Са(ОН)2.
Сумма молекулярных масс равна 228 + 90 = 244 + 74, а количество выделившейся извести по отношению к массе цемента составляет
mи = 56  %.
%.
В однокальциевом силикате известь и кремнезем, согласно молекулярным массам входящих веществ, соединяются в отношении
СаО · Si02 • Н20
56 - 60.
Тогда потребуется кремнезема
% (SiO2) = % (СаО) · 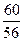 = 18, 2 •
= 18, 2 • 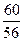 = 19, 5 %,
= 19, 5 %,
а всей гидравлической добавки, содержащей 22 % активного кремнезема
%(гидравлической добавки) = % (SiO2) · 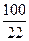 = 19, 5 ·
= 19, 5 · 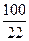 = 89 % от массы цемента.
= 89 % от массы цемента.
Отсюда отношение портландцемента к гидравлической добавке по массе составляет
1: 0, 89
Тогда пуццолановый портландцемент должен содержать портландцементного клинкера
% (портландцементного клинкера) = 100 · 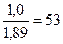 ,
,
а гидравлической добавки
% (гидравлической добавки) = 100 · 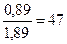
Пример 4.25. У какого из цементов наиболее полно используются вяжущие свойства? При приготовлении бетонов применялись шлакопортландцемент и пуццолановый цемент. Расход цемента для состава № 1 и № 2 соответственно составлял Ц1 = 320 и Ц2 = 350 кг/м3. Предел прочности при сжатии стандартных кубов в возрасте 28 суток был соответственно R1 = 26, 8 и R2 = 24, 7 МПа, количество химически связанной воды — В’х.с = 0, 12 и В”х.с =0, 11,
а степень гидратации цемента — a 1 = 0, 3 и а 2 = 0, 29.
Решение: Определяем коэффициенты К1 и К2 использования вяжущих свойств цемента в бетонах состава № 1 и № 2
К1 = 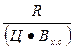 ;
;
К2 =  ,
,
где R — предел прочности при сжатии бетона или цементного камня, МПа; Ц — расход цемента, кг/м3; Вх.с — количество химически связанной цементом воды, в долях от массы цемента; а — степень гидратации цемента.
Для состава бетона на шлакопортландцементе
К1 = 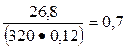 и К2 =
и К2 = 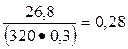 .
.
Для состава бетона на пуццолановом цементе
К1 = 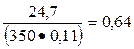 и К2 =
и К2 = 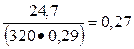
Коэффициенты K1 и К2 больше у бетона состава № 1, поэтому вяжущие свойства шлакопортландцемента используются более полно.
Пример 4.26. Цемент при полной гидратации связывает 15 % воды по отношению к массе цемента. Определить пористость цементного камня из теста с В/Ц = 0, 38, если степень гидратации составит а = 35 %. Истинная плотность цемента ри.ц.т = 3, 1 г/см3.
Решение: Абсолютный объем цементного теста из единицы массы цемента
Vц.т = 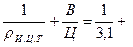 0, 38 = 0, 703
0, 38 = 0, 703
Абсолютный объем цементного камня
Vц.к = 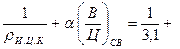 0, 35 · 0, 15 = 0, 375,
0, 35 · 0, 15 = 0, 375,
где а - коэффициент, учитывающий степень гидратации цемента.
Тогда пористость цементного камня
П = 
 %.
%.
Пример 4.27. Содержание воды в тесте из шлакопортландцемента 42 %, а для прохождения реакций гидролиза и гидратации требуется 18 % воды. Истинная плотность шлакопортландцемента — pи.ц = 2950 кг/м3. Определить пористость цементного камня.
Решение: Состав цементного теста (по массе) Ц: В = 1: 0, 42.
Абсолютный объем, занимаемый цементным тестом:
Vц.т = 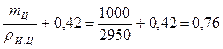 м3.
м3.
Абсолютный объем, занимаемый цементным камнем
Vц.к =  м3.
м3.
Относительная плотность цементного камня
pо.ц.к = 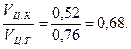
Тогда пористость цементного камня
П = (1 - pо.ц.к) = (1 – 0, 68) 100 = 32 %.
Пример 4.28. При испытании образцов-балочек размерами 40х40х160 мм на изгиб в возрасте 28суток получены следующие результаты Rизг: 5, 8; 6, 0; 6, 1МПа. Разрушающее усилие при испытании половинок балочек на сжатие составляло Rсж: 120; 125; 127, 5; 130; 132; 134 кН.
Определить марку портландцемента.
Решение: Согласно СТБ ЕН 196-1-2000 предел прочности при изгибе принимают как среднее значение из двух наибольших показателей прочности:
Предел прочности при сжатии находят как среднее из четырех наибольших значений показателей прочности. Последнее определяют как частное от деления разрушающего усилия на площадь пластинки (4 х 6, 25 см = 25 см2), через которую передают нагрузку на половину балочки. Произведя расчеты, получают результаты в МПа: 48, 0; 50, 0; 51, 0; 53, 0; 52, 8; 53, 6.
Среднее арифметическое из четырех наибольших результатов
Rср.сж = 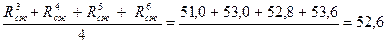 Мпа.
Мпа.
Цемент по пределу прочности при изгибе и сжатии соответствует М 500.
Пример 4.29. При испытании цементных образцов-балочек размерами 40 х 40 х 160 мм в возрасте 7 суток показатели предела прочности при изгибе Rср.сж = 3, 6; 3, 4; 3, 0 МПа. Среднеарифметическое значение предела прочности при сжатии составило Rср.сж = 29, 6 МПа.
Определить марку цемента.
Решение: Среднеарифметическое значение предела прочности при изгибе
Rср.изг = 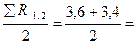 3, 5 МПа.
3, 5 МПа.
Зависимость между маркой цемента и пределом прочности образцов в возрасте 7 суток имеет логарифмический характер, т.е.
Rизг.п = 
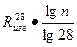 .
.
Подставляя известные показатели, получаем
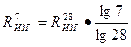 ;
;

Тогда
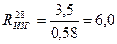 МПа.
МПа.
Прочность при сжатии в возрасте 28 суток
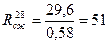 МПа,
МПа,
где 0, 58 – коэффициент перехода, найденный для 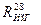 .
.
Ожидаемая марка цемента М 500.