
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Характеристические термодинамические функции.
|
|
Вопросы к коллоквиуму.
1. Критерии направленности самопроизвольных процессов в открытых системах. Функции Гельмгольца и Гиббса, их физический смысл и условия, в которых изменения этих функций становятся критериями направленности и достижения конечного состояния (равновесия) при протекании самопроизвольных процессов. Принципы равновесия Гиббса.
2. Термодинамические потенциалы.
3. Характеристические функции в обратимых и необратимых процессах. Показать для каких переменных параметров внутренняя энергия, энтальпия, функции Гельмгольца и Гиббса становятся характеристическими функциями (обратимые изменения состояния). Проанализировать свойства частных производных характеристических функций. Уравнения Максвелла.
4. Графические зависимости характеристических функций: U(S, T), H(S, P) и F(T, V), G(T, P).
5. Зависимости функций Гельмгольца и Гиббса от температуры. Уравнения Гиббса- Гельмгольца.
6. Стандартные изменения функции Гиббса в химических реакциях. Зависимость изменения функции Гиббса в химических реакциях от температуры. Примеры вычисления изменений функции Гиббса с использованием таблиц стандартных термодинамических свойств участников реакций (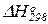 ,
, 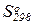 и Ср = f(T)).
и Ср = f(T)).
7. Характеристические функции для открытых термодинамических систем (с переменным составом компонентов). Химические потенциалы компонентов. Физический смысл химического потенциала i -того компонента.
8. Термодинамические системы с химическим взаимодействием компонентов (общий случай: необратимые или обратимые изменения состояния). Химическое сродство. Характеристические функции в реакционных системах. Связь между химическим сродством и химическими потенциалами реагентов.
Вопросы для самоконтроля.
1. Покажите, в каких условиях потенциалы функций Гельмгольца и Гиббса становятся критерием направленности и равновесия (конечного состояния) самопроизвольных процессов.
2. Один моль жидкости переходит в пар при постоянных Т и Р. Каково соотношение между DF и DG для этого процесса.
3. Для одного моля идеального однотомного газа определите в стандартных условиях значения F, G и Н.
4. Для одного моля идеального двухатомного газа определите в стандартных условиях значения F, G и Н.
5. Используя справочные термодинамические данные, рассчитайте изменения стандартных энтальпии, энтропии и потенциала Гиббса в следующих химических реакциях (условия стандартные):
| H2O(т)=H2O(г) | С(гр) = С(алм) |
| S(pомб) + H2(г) = H2S(г) | С2H5OH(ж) + 3O2(г) = 2CO2(г) + 3H2O(ж) |
| Fe2O3(т) + 3CO(г) = 2Fe(т) + 3CO2(г) | Fe2O3(т) + Н2(г) = 2Fe(т) + Н2О(г) |
| Fe2O3(т) + Al(т) = 2Fe(т) + Al2O3(т) | NH4Cl(т) = NH3(г) + HCl(г) |
| 2CO(г) + O2(г) = 2CO2(г) | I2(г)+ H2(г) = 2HI(г) |
6. Покажите, в каком направлении протекает каждая из приведенных в примере №5 реакций при 298 К. Какая из вычисленных величин указывает на степень (характер) влияния температуры на протекание реакции?
7. Определить в интервале 298 – 800К температурную зависимость  реакции разложения хлористого аммония NH4Cl(т) = NH3(г) + HCl(г) и оценить температуру, при которой реакция начинает протекать самопроизвольно (Р =1 атм).
реакции разложения хлористого аммония NH4Cl(т) = NH3(г) + HCl(г) и оценить температуру, при которой реакция начинает протекать самопроизвольно (Р =1 атм).
8. Энтальпия окисления графита С(гр) + О2 = СО2 в стандартных условиях DН (1) = - 393.522 кДж/моль. Энтальпия окисления азота по реакции N2 + 1/2O2 = NO2 DН (2) = + 33.095 кДж/моль. Постройте графические зависимости в координатах 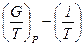 . Поясните, протеканию какой реакции будет способствовать увеличение температуры.
. Поясните, протеканию какой реакции будет способствовать увеличение температуры.
9. Покажите, для каких переменных параметров состояния внутренняя энергия (U) системы становится характеристической функцией. Нарисуйте графики зависимостей U от этих параметров и на их примере дайте трактовку частных производных.
10. Покажите, для каких переменных параметров состояния энтальпия (Н) системы становится характеристической функцией. Нарисуйте графики зависимостей Н от этих параметров и на их примере дайте трактовку частных производных.
11. Покажите, для каких переменных параметров состояния внутренняя энергия (F) системы становится характеристической функцией. Нарисуйте графики зависимостей F от этих параметров и на их примере дайте трактовку частных производных.
12. Покажите, для каких переменных параметров состояния внутренняя энергия (G) системы становится характеристической функцией. Нарисуйте графики зависимостей G от этих параметров и на их примере дайте трактовку частных производных.
13. Определить изменения DF и DG при изотермическом (Т=298) расширении идеального газа от V1=1 л (Р1=3 атм) до V2=2 л.
14. Для одного моля реального газа, подчиняющегося уравнению состояния 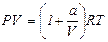 , определить изменение функции Гельмгольца при его изотермическом обратимом расширении.
, определить изменение функции Гельмгольца при его изотермическом обратимом расширении.
15. Для одного моля реального газа, подчиняющегося уравнению состояния 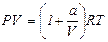 , определить изменение функции Гиббса при его изотермическом обратимом расширении.
, определить изменение функции Гиббса при его изотермическом обратимом расширении.
16. Доказать соотношения:  и
и 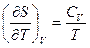 .
.
17. Доказать соотношения: а) 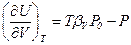 и б)
и б) 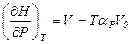 .
.
18. Доказать соотношения: а) 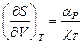 и б)
и б) 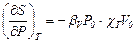 .
.
19. Две одинаковые болванки из свинца и меди (m = 500 г) помещаются при 298 K в пресс-форму. При сжатии от 1 до 1000 атмосфер болванки превращаются в изделие. Принять, что металлы пластичны и отношение 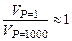 (близко к единице). Найдите изменение внутренней энергии заготовок из Pb и Cu при квазистатическом изотермическом сжатии. Для решения воспользуйтесь следующими данными: aР(Pb) = 0.861∙ 10-4 K-1, aР(Cu) = 0.501∙ 10-4 K‑ 1, CV(Pb) = 25.777 Дж/(моль∙ К), CV (Cu) = 23.676 Дж/(моль∙ К). Плотности r (Pb) = 11.334 г/см3, r (Cu)=8.62 г/см3.
(близко к единице). Найдите изменение внутренней энергии заготовок из Pb и Cu при квазистатическом изотермическом сжатии. Для решения воспользуйтесь следующими данными: aР(Pb) = 0.861∙ 10-4 K-1, aР(Cu) = 0.501∙ 10-4 K‑ 1, CV(Pb) = 25.777 Дж/(моль∙ К), CV (Cu) = 23.676 Дж/(моль∙ К). Плотности r (Pb) = 11.334 г/см3, r (Cu)=8.62 г/см3.
20. При 25 С мольный объем воды определяется соотношением 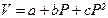 (cм3/моль) (для 0< P, атм< 1000, a =18.066, b = –0.000715, c =0.000000046). Изобарический коэффициент термического расширения воды
(cм3/моль) (для 0< P, атм< 1000, a =18.066, b = –0.000715, c =0.000000046). Изобарический коэффициент термического расширения воды 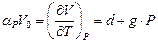 (см3/(град*моль)) (d=0.0045, g=0.0000014). Определить работу, необходимую для сжатия 1 моля воды от 1 до P атм при 25 °С и найти изменение ее внутренней энергии.
(см3/(град*моль)) (d=0.0045, g=0.0000014). Определить работу, необходимую для сжатия 1 моля воды от 1 до P атм при 25 °С и найти изменение ее внутренней энергии.
21. Покажите, что для одного моля идеального газа справедливы соотношения: а) 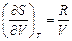 и б)
и б) 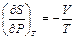
22. Покажите, что для одного моля реального газа, подчиняющемуся уравнению состояния Ван-дер-Ваальса 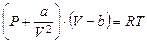 , справедливы соотношения: а)
, справедливы соотношения: а) 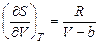 и б)
и б) 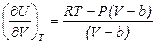 .
.
23. Покажите, что для одного моля реального газа, подчиняющемуся уравнению состояния 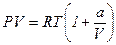 , справедливы соотношения: а)
, справедливы соотношения: а) 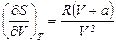 и б)
и б) 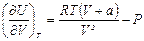 .
.
24. Докажите неравенства 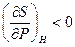 и
и 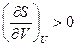 .
.
25. Покажите, что следующие процессы являются необратимыми: а) свободное адиабатическое расширение газа от объема V до объема V+dV и б) адиабатическое расширение газа из состояния с давлением p до давления p+dp.
26. Выразите коэффициент 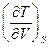 , определяющий изменение температуры при обратимом адиабатическом расширении газа, через параметры состояния и теплоемкость.
, определяющий изменение температуры при обратимом адиабатическом расширении газа, через параметры состояния и теплоемкость.
27. Выразите коэффициент Джоуля-Томсона 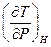 через параметры состояния, коэффициент термического расширения и теплоемкость произвольного газа.
через параметры состояния, коэффициент термического расширения и теплоемкость произвольного газа.
28. Выразите коэффициент Джоуля 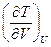 через параметры состояния и теплоемкость для газа Ван дер Ваальса.
через параметры состояния и теплоемкость для газа Ван дер Ваальса.
29. Давление насыщенного пара над жидкой водой и надо льдом соответственно равны 427.7 и 401.7 Па при 268 K. Какая из фаз в указанных условиях наиболее термодинамически стабильна? Ответ обосновать.