
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Коллоквиум 4.
|
|
Химическое равновесие.
Вопросы к коллоквиуму.
1. Условие химического равновесия. Вывод уравнения изотермы химической реакции, протекающей между газообразными веществами. Сокращенное уравнение изотермы химической реакции. Термодинамическое определение константы равновесия Kp. Связь Kp с константами равновесия Kc и Kx.
2. Вывод уравнения изотермы гетерогенной химической реакции, протекающей между твердыми и газообразными веществами. Сокращенное уравнение изотермы гетерогенной химической реакции. Константы равновесия Kp гетерогенной химической реакции.
3. Понятие о положении равновесия. Количественная оценка положения равновесия. Принцип смещения равновесия Ле Шателье. Влияние различных факторов на положение равновесия
4. Влияние давленияна положение равновесия химической реакции.
5. Влияние добавок инертного газа на положение равновесия химической реакции.
6. Влияние температуры на равновесие химической реакции. Вывод уравнения изобары Вант Гоффа. Вычисления температурной зависимости константы равновесия Kp с использованием таблиц стандартных термодинамических свойств участников реакций (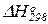 ,
, 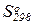 и Ср = f(T)).
и Ср = f(T)).
7. Расчет выхода продуктов в различных химических реакциях с использованием химической переменной и выражений для констант равновесия.
Вопросы для самоконтроля.
1. Может ли протекать химическая реакция при данной температуре, если для нее стандартное изменение функции Гиббса положительно?
2. Может ли протекать химическая реакция при данной температуре, если для нее изменение функции Гиббса положительно?
3. Вычислите стандартное изменение функции Гиббса и Kp реакции NH4Cl(т) = NH3(г) + HCl(г), если парциальные давления в состоянии равновесия равны P NH3=50662 Па и P HCl=50662 Па соответственно.
4. Какие из факторов (общее давление, температура) влияют на величину Kp.
5. Зависит ли величина Kp для данной реакции от способа записи ее уравнения? Ответ проиллюстрировать примерами.
6. Как сместится положение равновесия в реакции CH4+2H2S=CS2+4H2 при повышении общего давления, если все вещества при данной температуре находятся в газообразном состоянии?
7. Для каких реакций константа равновесия Kp равна общему давлению в системе при данной температуре. Приведите примеры таких реакций.
8. Как сместится положение равновесия в реакции COCl2(газ)=CO(газ)+Cl2(газ) при добавлении к равновесной системе инертного газа в следующих условиях:
а) при постоянном общем давлении;
б) при постоянном общем объеме?
9. В каком соотношении находятся величины Kp и Kc для реакции S2(тв)+4H2O(газ)=2SO2(газ)+4H2(газ)?
10. При температуре 1000 K протекают реакции диссоциации: 2HCl(газ)=H2(газ)+Cl2(газ) и 2H2O(газ)=2H2(газ)+O2(газ). Как изменится степень диссоциации HCl и H2O при повышении общего давления? Ответ обоснуйте.
11. Общее давление в равновесной системе NH4Cl(т) = NH3(газ) + HCl(газ) равно P. Выразите константу равновесия Kp этой реакции через общее давление.
12. Как изменится значение константы равновесия Kp и степени диссоциации AB2 в реакции AB2(газ)=A(газ)+2B(газ), если давление в системе увеличить в два раза?
13. После нагревания до 500°C 2 г фосгена при давлении 1 атм занимают в состоянии равновесия объем 1.985 л. Вычислить степень диссоциации фосгена согласно реакции COCl2(газ)=CO(газ)+Cl2(газ) и равновесные значения парциальных давлений всех газообразных участников.
14. Определить тепловой эффект реакции 2NO(газ)=N2(газ)+O2(газ) при температуре 1000 K, если температурная зависимость константы равновесия задана уравнением lg(Kp)= 0.5441-4725.5*(T, K)-1.
15. Для химической реакции A2(газ)=2A(газ) при 18°C Kc =0.17. Определите степень диссоциации при этой температуре и общем давлении, равном 1 атм. Какую величину имеет степень диссоциации при 19°C, если теплота реакции Qp =2.1*105 Дж?
16..В реакции образования водяного газа H2O(газ)+ CO(газ)=H2(газ)+CO2(газ) в равновесии при 1259 K находится 0.7 моль CO2; по 9.46 моль H2O и CO; 80.38 моль H2. Вычислить значение константы равновесия Kp.
17. При температуре 717 K константа равновесия Kp реакции H2+I2=2HI равна 0.01984. Если исходная смесь содержала 2.94 моля I2 и 8.1 моля H2, то чему равно число молей HI в равновесии при указанной температуре?
18. Для некоторой химической реакции зависимость суммы энтальпий исходных веществ и продуктов реакции от температуры изображена на рисунке. Как повлияет повышение температуры на константу равновесия Kp реакции? Аргументируйте ответ.

|
19. Для некоторой химической реакции зависимость суммы энтальпий исходных веществ и продуктов реакции от температуры изображена на рисунке. Изобразите температурную зависимость константы равновесия Kp реакции в координатах «ln(Kp)-1/T».

|
20. Для некоторой эндотермической химической реакции тепловой эффект реакции с ростом температуры увеличивается. Изобразите температурную зависимость константы равновесия Kp реакции в координатах «ln(Kp)-1/T».
21. Укажите условие, при котором для расчетов можно использовать уравнение
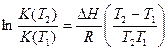 .
.
22. Определите изменение энтальпии реакции, константа равновесия которой при повышении температуры на 10 K от 298 K:
а) удваивается;
б) уменьшается в два раза?
23. Для реакций FeO(тв)+CO(газ)=Fe(тв)+CO2(газ) (1) и Fe3O4(тв)+CO(газ)=3FeO(тв)+CO2(газ) (2) получены следующие данные:
| T°C | |||||
| Kp(1) | 0.871 | 0.678 | 0.552 | 0.466 | 0.403 |
| Kp(2) | 1.150 | 1.770 | 2.540 | 3.430 | 4.420 |
Определите температуру, при которой Fe, FeO, Fe3O4, CO, и CO2 будут находиться все в равновесии
24. Определить состав равновесной системы, если исходная система заключена в объем 1 л и состоит из 0.03 молей FeO, 0.1 молей CO, 0.2 молей Fe, и 0.01 молей CO2 при температуре 800 K, если при этом протекает реакция FeO(тв)+CO(газ)=Fe(тв)+CO2(газ) с константой Kp =1.25. Прокомментируйте полученный результат.