
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вирулентности и факторов патогенности микроорганизмов
|
|
Цель занятия. Ознакомить студентов с техникой заражения лабораторных животных, целями и правилами их бактериологического исследования. Освоить методы определения вирулентности микроорганизмов и тестирования факторов патогенности бактерий.
Оборудование и материалы. Кровяной МПА в чашках Петри, стерильная плазма кролика (человека), культуры Е. coli, трупы мышей, зараженных Е. coli, белые мыши, морские свинки, кролики, стерильные шприцы, иглы, физиологический раствор.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Экспериментальное заражение лабораторных животных (биопроба). Этот метод применяют для выделения из исследуемого материала возбудителя болезни, испытания патогенности изучаемого микроорганизма, определения эффективности вакцин, иммунных сывороток и т. д.
О патогенности микроорганизма судят по его способности вызывать заболевание или гибель зараженного животного, а также по отдельным факторам патогенности (косвенные признаки).
Для заражения используют лабораторных животных разных видов (мышей, белых крыс, морских свинок, кроликов, голубей и др.). Выбор животного зависит от его чувствительности к исследуемому виду микроорганизма. В отдельных случаях заражают естественно-восприимчивых животных (свиней, крупный рогатый скот, овец и т. д.). Если изучают выделенную культуру микроорганизма, то для заражения берут 18...24-часовую агаровую или бульонную культуру. При заражении животных исследуемым материалом (ткани органов, гной, слизь, кровь и т. д.) последний предварительно растирают в ступке со стерильным физиологическим раствором. Для опыта берут животных, одинаковых по массе и возрасту.
Перед заражением животных метят: кроликов и морских свинок — металлическими ушными номерами; мышей и крыс — раствором краски (фуксин, метиленовый синий и т.д.). Для удобства и безопасности работы животных фиксируют. Морских свинок помощник держит брюшком вверх так, чтобы средний палец левой руки находился на шее, а большой и указательный — у передних конечностей животного. Правой рукой придерживают задние конечности. Мышь берут одной рукой за кончик хвоста, другой — за кожную складку затылка и поворачивают в нужное положение. Крыс фиксируют корцангами, захватив складку кожи затылка, плотно прижимают голову к поверхности стола, другой рукой держат за хвост и поворачивают в нужное положение, оттягивают корцангом голову (рис. 51...53).
Методы заражения животных. При заражении используют только стерильные инструменты — шприцы, иглы, ланцеты, пинцеты и др.
Скарификация (накожное заражение): на месте заражения предварительно выстригают шерсть и дезинфицируют кожу, затем скальпелем делают небольшие надрезы кожи (насечки) и в них втирают жесткой щеточкой исследуемый материал или бактериальную культуру.
Внутрикожное заражение: пальцами левой руки оттягивают кожу и в образовавшуюся между ними кожную складку вводят кончик иглы. Объем вводимого материала не должен превышать 0, 2 мл. Показатель правильного введения — припухлость размером с горошину.
Подкожное заражение: пальцами левой руки оттягивают кожу, в образовавшийся «кармашек» — складку вводят иглу шприца, затем его содержимое. Место заражения у кроликов — со стороны спины, несколько сбоку, у белых мышей и крыс — со спины к основанию хвоста. Объем вводимого материала не должен превышать для мышей 1 мл, для крыс, морских свинок — 10 мл, кроликов — 20...25 мл.
Внутримышечное заражение: материал чаще вводят с внутренней поверхности бедра. Голубей и кур заражают также и в грудную мышцу. Объем вводимого материала мышам 0, 5 мл, морским свинкам и крысам по 3...5 мл, кроликам 5...8 мл, большие дозы следует вводить дробно в два-три места.
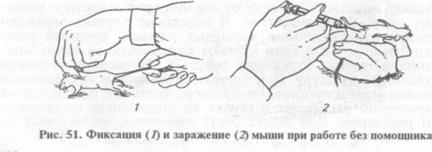
Внутрибрюшинное (интраперитонеальное) заражение: животное фиксируют головой вниз, иглу шприца вводят в нижнюю треть живота, чуть отступя от белой линии. Доза не должна превышать 0, 1...0, 2 мл.
Внутривенное заражение: исследуемый материал вводят кроликам в краевую вену уха, мышам и крысам — в вену хвоста. Перед заражением место инъекции протирают тампоном, смоченным ксилолом или теплой водой, чтобы вызвать наполнение сосудов кровью.
 |
Интрацеребральное заражение: животных фиксируют в положении на спине. У кроликов трепанируют череп на участке между надбровным углом и черепным гребнем. Выстригают шерсть и дезинфицируют кожу, пальцами левой руки растягивают ее над глазницей параллельно черепному гребню и рассекают (края раздвигают), крестообразно разрезают надкостницу, маленьким трепаном прокалывают осторожно черепную кость, осторожным поворотом выпиливают диск и этот небольшой кусочек кости извлекают. Шприцем вводят 0, 2 мл исследуемого материала. После этого осторожно соединяют края надкостницы, кожную рану закрывают тампоном и заливают коллодием. У мышей и крыс трепанацию не делают, а легким проколом костной ткани черепа вводят кончик тонкой иглы и инъецируют материал.
Интраназальное заражение: животное предварительно слегка наркотизируют, прикладывая к носу вату, смоченную эфиром, затем с помощью глазной пипетки вводят материал.
Оральное заражение: исследуемый материал добавляют в корм, воду или вводят через небольшой зонд.
Кроме того, животных заражают в переднюю камеру глаза.
Бактериологическое исследование трупа животного. Проводят с целью выделения чистой культуры микроба при диагностических исследованиях либо для подтверждения специфической природы гибели животного при заражении чистой культурой микроорганизма.
Трупы животных вскрывают, соблюдая правила асептики. Тело животного фиксируют в положении на спине на доске или в кювете с парафином. Кожно-шерстный покров дезинфицируют 5%-м раствором фенола или лизола. Разрезают кожу по белой линии от промежности до грудинно-ключичного сочленения. Затем кожу отделяют от мышц, делают поперечные надрезы и кожные лоскуты отводят в сторону. Пинцетом захватывают мечевидный отросток, под ним надрезают мышцы, ножницами с обеих сторон рассекают ребра, грудину откидывают кверху.
Сначала вскрывают грудную полость. Учитывают патолого- анатомическую картину, записывают данные в журнале экспертизы. Поверхность сердца, легких, лимфатических узлов прижигают раскаленным шпателем, пастеровской пипеткой прокалывают в этом месте орган, насасывают небольшое количество крови (тканевой пульпы) и высевают ее на питательные среды, соблюдая стерильность (рис. 54).

Затем вскрывают брюшную полость. Пинцетом оттягивают вверх брюшную стенку и ножницами разрезают ее от диафрагмы до анального отверстия (важно не повредить кишечник!). Осматривают органы брюшной полости, отмечая размеры, цвет и консистенцию паренхиматозных органов, состояние кишечника, наличие экссудата в брюшной полости и его характер. Также после прижигания поверхности делают посевы из печени, почек, селезенки, лимфатических узлов, в случае необходимости из содержимого кишечника и других органов. Параллельно из тканей органов готовят мазки-отпечатки для микроскопического исследования: стерильными ножницами отрезают кусочек органа и к поверхности разреза несколько раз отдельными участками прикладывают предметное стекло; препарат подсушивают на воздухе, фиксируют, окрашивают, микроскопируют.
По аналогичной схеме исследуют трупы и других экспериментально зараженных животных, а также отдельные органы и ткани сельскохозяйственных животных (патологический материал), поступающие в лабораторию для исследования. При работе с трупами соблюдают меры, предупреждающие распространение возбудителя инфекции. После окончания исследования кюветы, доски, рабочий стол дезинфицируют. Инструменты стерилизуют. Трупы животных и отдельные органы обеззараживают автоклавированием или сжигают в трупосжигательной печи.
Определение вирулентности и токсигенности микроорганизмов. В повседневной диагностической практике обычно ограничиваются установлением факта патогенности микроорганизма; при оценке биопрепаратов необходимы количественные характеристики вирулентности микроорганизма, взятого для заражения животного.
Вирулентность (токсигенность) микроба измеряют в специальныx условных единицах: абсолютная летальная доза (Dсl — dosis certae letalis) вызывает гибель 100 % зараженных животных; 50%-я летальная доза (LD50) — 50 % зараженных животных; 50%-я инфицирующая доза (ID50) вызывает заболевание 50% зараженных животных. LD50 и ID50 —наиболее точные показатели, поскольку отражают чувствительность к возбудителю (токсину) большинства взятых в опыт животных, a Del показывает чувствительность наиболее устойчивых особей.
Для расчета LD50 исследуемой культуры микроорганизма используют один из приведенных методов. Готовят суспензию бактерий с известным содержанием микробных клеток в единице объема. Затем делают последовательные (2, 5, 10-кратные) разведения суспензии на стерильном физиологическом растворе и равные объемы каждого разведения вводят (подкожно, внутрибрю-шинно и т. д.) чувствительным лабораторным животным. Если определяют летальный эффект, то учитывают количество погибших животных и рассчитывают LD50. Поскольку обычно ни одна из доз возбудителя не приводит к гибели строго 50 % зараженных животных, LD50 определяют статистическими методами.
Расчет LD50 по методу Рида и Мета. Например, из суспензии с концентрацией клеток 109/мл были приготовлены десятикратные разведения Ю-2, Ю-3 и т.д. По 0, 5мл каждого разведения ввели внутрибрюшинно шести белым мышам. Результаты заражения показаны в таблице 3.
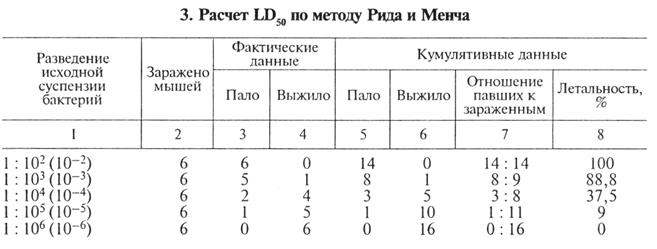
В графах 3 и 4 приведены фактические цифры гибели животных, зараженных различными дозами возбудителя. В графах 5 и 6 указаны так называемые кумулятивные данные. Например, в графе 5 напротив дозы 10-2 стоит число 14, оно получено из предположения, что при заражении всех мышей одной этой дозой (максимальной) пали бы все животные, которые погибли после введения меньших доз (10-3, 10-4 и т.д.). Поэтому мы имеем формальное право суммировать напротив дозы 10-2 в графе 5 всех мышей, павших от этой и меньших доз: 6 + 5 + 2 + 1 = 14 мышей. Аналогичным образом определяем кумулятивные данные в графе 5 напротив каждой дозы Таким же образом определяем кумулятивные данные для всех доз по графе 6 (выжившие животные). Например: при заражении мышей минимальной дозой 10-6 выжило 6 мышей и, безусловно, выжили бы все животные, которые остались живы после заражения большей дозой бактерий. Исходя из этого, кумулятивный показатель при дозе 10-6 составляет: 6 + 5 + 4+1 = 16 мышей. Аналогичным образом определяем это число для остальных доз.
На следующем этапе, основываясь на кумулятивных данных, рассчитывают процент гибели мышей при заражении каждой дозой микроорганизма. Как видно, ни одна доза не приводит к гибели 50 % мышей, и этот показатель рассчитывают математически.
В нашем случае LD50 находится между дозами 10-3 и 10-4, немного ближе к 10-4. Маленькую разницу (от 37, 5 до 50 %) соотнесем с большей (от 88, 8 до 37, 5 %) и получим фактор пропорциональности, на который доза 10-4 отличается от LD50. Этот фактор умножаем на логарифм разведения, который в нашем примере равен 1, 0 (фактор = 10, lg 10 = 1, 0). Эту величину вычитаем из 10-4 и получаем LD50:
50-37 5=12 5
------- ----- —=0, 243 (фактор пропорциональности);
88, 8—37, 5=51, 3
0, 243-1 =0, 243; 4, 0-0, 243 = 3, 756.
Следовательно, LD50=10-3, 756. Чтобы найти разведение бактериальной суспензии, соответствующее вычисленному показателю LD50, используют логарифмические таблицы. Антилогарифм и одновременно искомое разведение составляют 1: 5747. Для заражения животных использовали суспензию бактерий с концентрацией клеток 109/мл в объеме 0, 5 мл, следовательно, LD50 = 109 0, 5/5747 = 87 000 микробных клеток.
Расчет LD50 по методу Кербера. Для получения точных результатов необходима положительная ответная реакция в диапазоне от 100 до 0 %.
Рассмотрим пример расчета на основании тех же данных, которые приведены в таблице 3.

Сумму констант (2, 32) рассматривают как характеристику процесса в целом. Логика дальнейших рассуждений следующая.
Из суммы 2, 32 вычитаем значение константы, соответствующей 50%-й реакции (0, 5): 2, 32 - 0, 5 = 1, 82. На степень 1, 82 показатель LD50 отличается от 100%-й реакции.
Число 1, 82 умножаем на значение логарифма интервала между разведениями исходной бактериальной суспензии, а поскольку разведения десятикратные, то получим
1, 82 - 1, 00= 1, 82.
Далее суммируем 1, 82 с показателем степени разведения суспензии (1/102), при котором константа реакции равна 1, 0: 1, 82 + 2, 0 = 3, 82, т. е. LD50 = 10-3, 82 Все это можно выразить следующей формулой:
LD50 = lgl/102 + lg 10 (Е-0, 5),
где lg 1/102 — логарифм разведения с константой реакции 1, 0; lg 10 — логарифм интервала (кратность разведения может быть 2, 5 и т. д.); X — сумма констант реакций.
Используя таблицу антилогарифмов, показатель 10-3, 82 переводят в абсолютную величину.
Выявление токсинов микроорганизмов. Обнаружение экзотоксинов лежит в основе лабораторной диагностики многих инфекционных заболеваний (ботулизма, энтеротоксемии овец и др.), а также микотоксикозов. В этих случаях материал, предположительно^ содержащий токсин, вводят (скармливают, наносят на поверхность кожи) чувствительным биологическим моделям (лабораторные, сельскохозяйственные животные и др.) и по их гибели, заболеванию, изменениям в органах и тканях судят о наличии токсина. Разработаны иммунологические методы идентификации токсинов (см. тему 19).
Кроме того, обнаружение токсинов и определение их количества необходимы для приготовления биопрепаратов. Например, иммунитет при ботулизме, энтеротоксемии в значительной мере антитоксический, присутствие токсина (в виде анатоксина) в вакцине определяет иммуногенность препарата. Поэтому необходимо точно определять количество токсина в культуральной жидкости. В этом случае устанавливают содержание токсина в 1 мл культуральной жидкости на чувствительных животных, рассчитывая LD50, например, по методу Кербера.
Выявление других факторов патогенности микроорганизмов. Заключение о патогенности микроорганизма делают как по результатам биопробы (прямое доказательство), так и по ряду признаков, косвенно свидетельствующих о патогенных свойствах выделенного микроба. Наиболее часто применяют следующие тесты.
Тест на плазмокоагулазу. Коагулаза — фермент бактерий (стафилококков), который в сочетании с некоторыми компонентами сыворотки коагулирует плазму. Благодаря коагу-лазе вокруг стафилококковых поражений образуется фибринозный барьер, облегчающий персистенцию бактерий в тканях, кроме того, отложения фибрина на поверхности бактериальных клеток затрудняют их фагоцитоз.
Петлю бактериальной массы исследуемой культуры, снятой с поверхности агаровой среды, смешивают с 0, 5 мл плазмы крови кролика (человека), не разведенной или разведенной стерильным физиологическим раствором в соотношении 1: 4, инкубируют при 37 º С, результаты учитывают через 4 и 24 ч. Положительная реакция — образование сгустка.
Тест на гиалуронидазу. Гиалуронидаза — фермент, расщепляющий гиалуроновую кислоту и, как следствие, деполимеризующий межклеточное вещество. Рассматривают как фактор инвазивности бактерий. Получение гиалуронового субстрата (из пупочных канатиков) — довольно сложная процедура. На практике удобнее использовать тест декапсуляции бактерий. В качестве субстрата в этом случае берут культуры бактерий, в капсульном веществе которых есть гиалуроновая кислота (P. multocida серовар A, S. equi).
На поверхность агара в чашке Петри дробно засевают культуру P. multocida или S. equi. Затем в виде линии высевают на поверхность среды культуру микроорганизма, у которого выявляют способность к синтезу гиалуронидазы. Чашки с посевами инкубируют при 37 °С 16...24 ч. Если исследуемый микроорганизм выделяет гиалуронидазу, то она диффундирует в толщу питательной среды и разрушает капсулу тест-микроба. При анализе посевов в косопроходящем пучке света колонии S. equi (P. multocida) вблизи «штриха» исследуемой культуры меньше по размеру, серого или голубого цвета в отличие от флуоресцирующих отдаленных колоний.
Тест на гемолизин. Бактериальные гемолизины — обширная группа веществ-мембранотоксинов, которые вызывают нарушение целостности мембраны эритроцитов и их лизис.
Исследуемую культуру уколом или дробно засевают в чашки Петри с 5%-м кровяным агаром, посевы инкубируют при 37 °С 24 ч. Гемолизин, выделяемый растущей культурой бактерий, диффундирует в толщу агара и вызывает лизис эритроцитов, что проявляется в виде светлой (бета-гемолиз) или полупрозрачной (альфа-гемолиз) зоны вокруг колоний. Гемолитическую активность микроорганизма можно также определять его посевом в 1...5%-й кровяной бульон, который после культивирования выделяющего гемолизин микроба становится прозрачным за счет лизиса эритроцитов.
Тест на фибринолизин (стрептокиназу). Многие гемолитические стрептококки образуют стрептокиназу, которая активирует протеолитический фермент плазмы (плазминоген → плазмин), этот фермент — фибринолизин растворяет коагулированную плазму.
Исследуемую культуру микроорганизма засевают в виде «бляшки» на агар с 12% цитрированной плазмы. Посевы инкубируют при 37 º С 23...24 ч. Положительный результат — появление зоны просветления вокруг колонии.
Тест на лецитиназу. Лецитиназа расщепляет гидролизом лецитин. Готовят желточный агар: пептон — 20 г, гидрофосфат натрия — 2, 5 г, натрий — 1 г, 0, 5%-й раствор сульфата магния — 0, 1 мл, глюкоза—1 г, агар—12, 5 г, вода дистиллированная — 500 мл. Устанавливают рН 7, 2...7, 4, стерилизуют при 121 °С 15 мин, охлаждают до 55 º С, добавляют один стерильный желток на 500 мл среды, компоненты перемешивают и смесь разливают в чашки Петри.
Исследуемую культуру засевают дробно на желточный агар, культивируют при 37...38 °С 24...48 ч. Положительный результат — появление зоны помутнения вокруг колоний.
Тест на ДНК-азу. Исследуемую культуру бактерий засевают «штрихом» на питательный агар с ДНК и культивируют при 37 °С 24 ч. Затем на поверхность среды с бактериальной культурой наливают 1 н. раствор соляной кислоты. Положительный результат — при гидролизе ДНК вдоль «штриха» культуры видна светлая зона.
Питательная среда с ДНК: в расплавленный МПА добавляют 10%-й раствор ДНК до конечной 0, 2%-й концентрации, перемешивают компоненты, автоклавируют при 120 °С 15 мин и разливают в чашки Петри.
Тесты на другие ферменты. Как факторы патогенности можно рассматривать ферменты, катализирующие реакции с образованием токсических продуктов, например: уреаза гидролизует мочевину с образованием аммиака; декарбоксилаза декарбоксилирует аминокислоты с образованием аминов и т.д. Методы обнаружения этих ферментов изложены в теме 9.
Тест на адгезины. В адгезии бактерий принимают участие различные компоненты оболочки. Это свойство выявляют по способности исследуемого микроорганизма сорбироваться на различных эукариотических клетках (эритроциты, энтероциты) или других частицах (латекс). Еще один метод обнаружения адгезинов связан с их использованием в качестве антигенов в серологических реакциях. У эшерихий адгезивные свойства часто определяют по их способности агглютинировать эритроциты.
В лунки планшетов вносят по 50 мкл 4%-й суспензии отмытых эритроцитов морской свинки, 1%-й раствор D-маннозы, суспензию исследуемых бактерий с концентрацией клеток 109/мл. Параллельно ставят реакцию в отсутствие маннозы. Результат учитывают через 30...60 мин. Положительная реакция — склеивание и оседание эритроцитов в виде «зонтика». Торможение агглютинации маннозой обозначают как маннозочувствительную ГА (гемагглютинация), отсутствие ингибирования — как маннозорезистентную ГА.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Освоить методы заражения лабораторных животных.
2. Провести бактериологическое исследование трупа лабораторного животного.
3. По готовым цифровым данным рассчитать LD50 микроорганизма.
4. Ознакомиться с проявлением гемолитической, плазмокоа-гулазной, гиалуронидазной активности микроорганизмов.
Контрольные вопросы
1. Какими методами заражают лабораторных животных?
2. Каковы основные правила бактериологического исследования трупов живот-
ных?
3.С какой целью и какими методами рассчитывают LD50 микроорганизмов?
4.Какими методами определяют факторы патогенности микроорганизмов?