
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Постулаты Бора
|
|
Следующий шаг в развитие представлений о устройстве атома в 1913 сделал БОР. Он пришел к выводу, что при описании поведения атомных систем следует отказаться от многих классических представлений. Он сформулировал постулаты. Он сформулировал постулаты, которые должны удовлетворять новой теории.
1-й постулат (постулат стационарных состояний)
Атом может находиться только в особых стационарных состояниях, каждому из которых соответствует определенная энергия E_n. В стационарных состояниях атом не излучает. Электрон может находиться только на строго определенных орбитах, которые называются стационарными. Двигаясь по стационарным орбитам электрон не излучает энергию и должен и должен иметь дискретные квантовые значения момента импульса, удовлетворяющему следующему соотношению. (m*v_n)*(r_n)=n*ђ, n=1, 2… ђ=h/2π
2-й постулат
При переходе электрона с одной стационарной орбиты с энергиями E_n на другие с энергией E_m излучается или поглощается фотон с энергией равной разности соответствующих энергий стационарных состояний атома. Hν =E_n-E_m
Теория Бора не отвергала полностью законы классической физики, в ней сохранились представления об орбитальном движении электрона в кулоновском поле ядра. Классическая ядерная модель Резерфорда была дополнена теорий Бора о квантовании электронных орбит, поэтому теорию Бора называют полумеханической. Рассмотрим движение электрона в водородоподобной системе. Электрон движется по окружности и подчиняется законам динамики
m*(v_n^2)/(r_n^2)=k*(Ze)/(r_n^2) решая это уравнение совместно со вторым постулатом Бора найдем r_n – n-й радиус орбиты
Для атома водорода при при r_n=1 решая совместно два уравнения m*(v_n^2)=k*e^2/r_n и m*v_n*r_n=n*ђ получим v_n^2=k*e^2/(m*r_n)
r_n=(n^2*ђ^2)/(m*k*e^2)
Отсюда следует, что радиусы орбит растут пропорционально квадратам целых чисел. Т.к. радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально, например энергия излучения или поглощения атомом водорода.
Полная энергия атома складывается из кинетической энергии и потенциальной энергии в электростатическом поле ядра.
E=E_k+E_п=(m* v_n^2)/2 + (- k*e^2/r_n) m*v_n^2=k*e^2=k*e^2/r_n => m*v_n^2=k*e^2/r_n
E=E_k+E_п =(k*e^2)/(2*r_n)- (k*e^2)/(r_n)=-(k*e^2)/(2*r_n) или
E=(-1/2)*((e^2)/(4π ε r_n))= -(1/n^2)*((m*e^4)/(8*ε ^2*h^2))
Знак – означает, что электрон находится в связанном состоянии. Из формулы видно, что энергетические состояние атома образуют последовательность уровней, зависящих от n.
Целое число n определяющее энергетический уровень атома называется главным квантовым числом
Состояние атома с минимальной энергией, т.е с n=1 называется основным состоянием, Остальные – возбужденные.
Радиус орбиты и энергии в основном состоянии равны E_1=-21, 7*10^(-19) Дж = -13б6 эВ r_1=0, 53*10^(-8) см
Чтобы ионизировать атом в основном состоянии электрону надо сообщить энергию E_1. Это энергия ионизации, т.е энергия необходимая для отрыва электрона от атома.
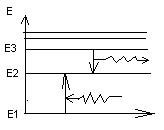 Подставляя n в формулу получим разные E Энергия атома с ростом n возрастает и расстояние между уровнями уменьшается при приближении к границе.
Подставляя n в формулу получим разные E Энергия атома с ростом n возрастает и расстояние между уровнями уменьшается при приближении к границе.