
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 1.3. Дослідження кінетики реакції окиснення йодиду калію персульфатом калію.
|
|
Мета роботи: визначити частинний порядок реакції за персульфатом калію, установити залежність константи швидкості реакції від температури і обчислити енергію активації.
Досліджувана реакція перебігає за рівнянням:
К2S2O8 + 2KI = 2K2SO4 + I2. (1.16)
Якщо йодид калію взято у великому надлишку, то його концентрація в ході реакції практично не змінюється. В цьому випадку реакція має порядок, що відповідає частинному порядку за персульфатом калію.
В одну склянку або колбу мірною піпеткою наливають 50 см3 0, 04–нормального розчину К2S2O8, а в другу – 50 см3 0, 4–нормального розчину KI. Склянки занурюють у налаштований на певну температуру термостат і витримують приблизно 7 – 10 хвилин для нагрівання реагентів до температури досліду. Після цього розчини зливають, залишаючи ємність з досліджуваною системою в термостаті, та вмикають секундомір. Реакційна суміш повинна бути закритою, тому що йод легко випаровується.
Через певні проміжки часу (за вказівкою викладача, залежно від температури досліду) відбирають піпеткою 10 см3 суміші. За температур 32 о С і 39 о C проби бажано відбирати кожні 4 хвилини; за 25 о C – кожні 5 хвилин; за кімнатної температури – залежно від її значення, враховуючи те, що сумарна кількість титрувань складає 9. Пробу виливають у конічну колбу, яка містить приблизно 100 см3 холодної дистильованої води. В результаті виливання у воду концентрація розчину зменшується і він охолоджується, внаслідок чого реакція значно сповільнюється. Тому часом відбору проби слід вважати момент виливання її у воду.
Йод, який виділився під час реакції (1.16), титрують 0, 01–нормальним розчином тіосульфату натрію за наявності крохмалю до зникнення синього забарвлення. Реакція, що перебігає при титруванні, має вигляд:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Експеримент припиняють тоді, коли витрачений на титрування трьох послідовних проб об’єм Na2S2O3 залишається практично незмінним.
Будують графік  та розраховують константи швидкості реакції(якщо внаслідок похибок експерименту окремі точки лежать поза плавною кривою, то ці дані не використовують для розрахунку константи швидкості). Припускаючи, що частинний порядок за К2S2O8 є першим, константу швидкості реакції обчислюють за рівнянням (1.5). До формули (1.5) входить концентрація вихідної речовини (персульфату калію), а титруванням визначають концентрацію продукту реакції (І2). Кількість йоду, що виділяється за певний проміжок часу з початку реакції, пропорційна кількості персульфату, який реагує за цей час, і відповідає об’єму Na2S2O3, що витрачається на титрування реакційної проби. Кінцева концентрація йоду пропорційна початковій концентрації К2S2O8 і, відповідно, максимальному об’єму Na2S2O3. Тому замість х у формулу (1.5) підставляють об’єм тіосульфату V, який витрачено на титрування проби в певний момент часу, а замість
та розраховують константи швидкості реакції(якщо внаслідок похибок експерименту окремі точки лежать поза плавною кривою, то ці дані не використовують для розрахунку константи швидкості). Припускаючи, що частинний порядок за К2S2O8 є першим, константу швидкості реакції обчислюють за рівнянням (1.5). До формули (1.5) входить концентрація вихідної речовини (персульфату калію), а титруванням визначають концентрацію продукту реакції (І2). Кількість йоду, що виділяється за певний проміжок часу з початку реакції, пропорційна кількості персульфату, який реагує за цей час, і відповідає об’єму Na2S2O3, що витрачається на титрування реакційної проби. Кінцева концентрація йоду пропорційна початковій концентрації К2S2O8 і, відповідно, максимальному об’єму Na2S2O3. Тому замість х у формулу (1.5) підставляють об’єм тіосульфату V, який витрачено на титрування проби в певний момент часу, а замість 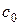 – максимальний об’єм тіосульфату
– максимальний об’єм тіосульфату 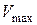 , що відповідає закінченню реакції.
, що відповідає закінченню реакції.
Результати експерименту записують у табл. 1.7 (див. звіт).
Для визначення енергії активації реакції аналогічний дослід проводять
за 3 – 4 температур. Отримані результати для всіх температур зводять у
табл. 1.8 (див. звіт). За даними табл. 1.8 будують графік 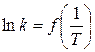 ,
,
визначають тангенс кута нахилу прямої і за рівнянням (1.13) обчислюють енергію активації реакції.
Звіт
1. Дані експерименту:
температура досліду 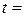 о C.
о C.
Таблиця 1.7. Залежність об’єму Na2S2O3, який витрачено на титрування реакційної проби, від часу
Час від початку реакції 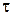 , хв. , хв.
| ||||||||||
Об’єм Na2S2O3 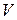 , см3 , см3
|
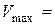 см3.
см3.
2. Побудова за даними табл. 1.7 графіка  .
.
3. Обчислення за формулою  констант швидкості реакції
констант швидкості реакції
(хв.-1):
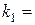 ;
; 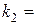 ;
; 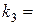 ; ……..
; …….. 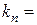 ;
; 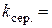
4. Висновок стосовно частинного порядку реакції за К2S2O8 та її кінетичне рівняння:
5. Дані для графічного визначення енергії активації досліджуваної реакції:
Таблиця 1.8. Залежність константи швидкості реакції від температури
| t, о C | 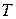 , K , K
|  , К-1 , К-1
| 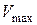 , см3 , см3
|  , хв.-1 , хв.-1
| 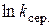
|
| t в лабораторії | |||||
6. Побудова графіка 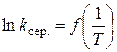 та визначення за ним енергії активації реакції на основі формули (1.13).
та визначення за ним енергії активації реакції на основі формули (1.13).
7. Висновок.
ЛІТЕРАТУРА: [1, с. 523 – 542, 616 – 623; 2, с. 290 – 310, 313 – 315, 427 – 433; 3, с. 318 – 329, 337 – 341, 402 – 406; 4, с. 322 – 346; 5, с. 195 – 206; 6, с. 217 – 225, 229 – 236; 8, с. 43 – 47].