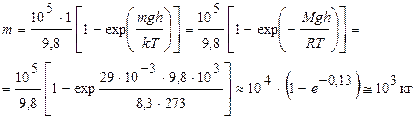Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 1. Определить число N молекул, содержащихся в объеме V=1 мм3 воды, и массу m1 молекулы воды
|
|
Пример 1. Определить число N молекул, содержащихся в объеме V =1 мм3 воды, и массу m 1 молекулы воды. Считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр d молекул.
Решение. Число n молекул, содержащихся в некоторой массе m, равно произведению числа Авогадро NA на количество вещества n:
N = n NA.
Так как количество вещества
n = m/m,
где m - молярная масса, то
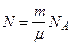 .
.
Выразив в этой формуле массу как произведение плотности на объем V, получим
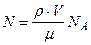 (1)
(1)
Подставим в формулу (1) следующие значения величин: r =103 кг/м3; V = 1 мм3=10-9 м3; m =18× 10-3 кг/моль; NA =6, 02× 1023 моль-1 и произведем вычисления:
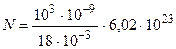 молекул=3, 34× 1019 молекул.
молекул=3, 34× 1019 молекул.
Массу m1 одной молекулы можно найти делением молярной массы на число Авогадро:
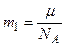 .
.
Подставив сюда числовые значения m и N, найдем массу молекулы воды:
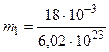 кг = 2, 99× 10-26 кг.
кг = 2, 99× 10-26 кг.
Если молекулы воды, плотно прилегают друг к другу, то можно считать, что на каждую молекулу приходится объем (кубическая ячейка) V1=d3, где d - диаметр молекулы. Отсюда
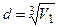 . (2)
. (2)
Объем V 1 найдем, разделив молярный объем Vm на число молекул в моле, т.е. на число Авогадро N A:
V1 =Vm /NA.
Подставим полученное выражение V 1 в формулу (2):
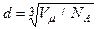 .
.
Входящий в эту формулу молярный объем определяется выражением Vm =m / r. Тогда искомый диаметр молекулы
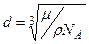 (3)
(3)
Проверим, дает ли правая часть выражения (3) единицу длины:
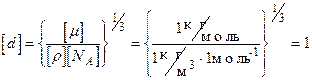 м.
м.
Теперь подставим числовые значения физических величин в формулу (3) и произведем вычисления:
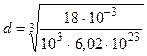 м = 3, 11× 10-10 м = 311 пм.
м = 3, 11× 10-10 м = 311 пм.
Пример 2. В баллоне объемом V = 10 л находится гелий под давлением р1 =1 МПа и при температуре
Т 1 = 300 К. После того как из баллона было взято
m =10 г гелия, температура в баллоне понизилась до Т 2=290 К. Определить давление р 2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, применив его к конечному состоянию газа:
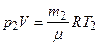 , (1)
, (1)
где m2 -масса гелия в баллоне в конечном состоянии; m - молярная масса гелия; R - молярная газовая постоянная.
Из уравнения (1) выразим искомое давление р2:
 . (2)
. (2)
Массу гелия m 2 выразим через массу m 1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
m2 = m1 - m. (3)
Массу гелия m 1 найдем также из уравнения Менделеева-Клапейрона, применив его к начальному состоянию:
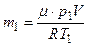 . (4)
. (4)
Подставляя в выражение (3) массу m 1 из формулы (4), а затем полученное выражение m 2 в формулу (2), найдем
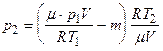 ,
,
или после преобразования и сокращения
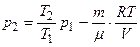 . (5)
. (5)
Пример 3. Баллон содержит m 1=80 кг кислорода и m 2=320 г аргона. Давление смеси p =1 МПа, температура Т =300 К. Принимая данные газа за идеальные, определить объем V баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальным давлением газа называется давление, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
По уравнению Менделеева-Клапейрона, парциальные давления кислорода p 1 и аргона р 2 выражаются формулами:
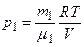 ;
; 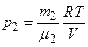 .
.
Следовательно, по закону Дальтона давление смеси газов
р = р 1+ р 2, или 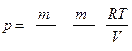 ,
,
откуда объем баллона
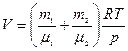 (1)
(1)
Выразим в единицах СИ числовые значения величин, входящих в формулу: m 1=80 г=0, 08 кг, m1=32× × 10-3 кг/моль, m 2=320 г=0, 32 кг, m2=40× 10-3 кг/моль, р =1 МПа=106 Па, R =8, 31 Дж/(моль× К).
Подставим числовые значения в формулу (1) и произведем вычисления:
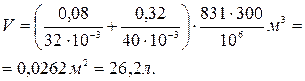
Пример 4. Вычислить удельные теплоемкости сv и cp смеси неона и водорода, если массовая доля неона w 2=20 %. Значения удельных теплоемкостей газов взять из предыдущего примера.
Решение. Удельную теплоемкость смеси при постоянном объеме cv найдем следующим образом. Теплоту, необходимую для нагревания смеси на D Т, выразим двумя способами:
Q=cV (m 1 +m 2)D T, (1)
Q= (cV, 1 m 1 +cV, 2 m 2)D T, (2)
где сV, 1 - удельная теплоемкость неона; сV, 2 - удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на D Т, получим
сV (m 1 +m 2)= cV, 1 m 1 +cV, 2 m 2,
откуда
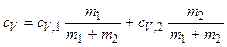 , (3)
, (3)
или
сV = cV, 1 w 1 +cV, 2 m 2, (4)
где 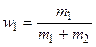 и
и 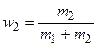 - массовые доли неона и водорода в смеси.
- массовые доли неона и водорода в смеси.
Подставив в формулу (4) числовые значения величин, найдем:
сV = (6, 24× 102× 0, 8+1, 04× 104× 0, 2) Дж/(кг× К) =
= 2, 58× 103 Дж/(кг× К).
Рассуждая таким же образом, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
ср = ср, 1 w 1 + c p , 2 w 2. (5)
Подставим в формулу (5) числовые значения величин:
ср= 1, 04× 103× 0, 8+1, 46× 104× 0, 2 Дж/(кг× К)=3, 75× 103 Дж/(кг× К).
Пример 5. Кислород массой m =2 кг занимает объем V 1=1 м3 и находится под давлением р 1=0, 2 МПа. Газ был нагрет сначала при постоянном давлении до объема V 2=3 м3, а затем при постоянном объеме до давления р 3=0, 5 МПа. Найти изменение D U внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
Решение. Изменение внутренней энергии газа выражается формулой
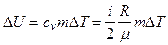 (1)
(1)
где i -число степеней свободы молекул газа (для двухатомных молекул кислорода i =5); m-молярная масса.
Начальную и конечную температуру газа найдем из уравнения Клапейрона-Менделеева 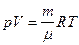 :
:
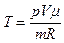 . (2)
. (2)
Выпишем заданные величины в единицах СИ: m= 2 кг, m=32× 10-3 кг/моль, R =8, 31 Дж/(моль× К), V 1=1 м3, V 2= V 3=3 м3, р 1= р 2=0, 2 МПа=2× 105 Па, р 3=0, 5 Мпа =
=5× 105 Па. Подставляя эти значения в выражение (2) и выполняя арифметические действия, получим:
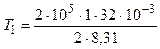 К = 385 К;
К = 385 К;
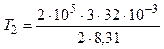 К = 1155 К = 1, 16 кК;
К = 1155 К = 1, 16 кК;
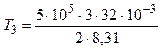 К = 2887 К = 2, 89 кК.
К = 2887 К = 2, 89 кК.
Подставляя в выражение (1) числовые значения величин, входящих в него, и выполняя арифметические действия, находим
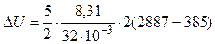 Дж= 3, 24× 106 Дж =3, 24 МДж
Дж= 3, 24× 106 Дж =3, 24 МДж
Работа расширения газа при постоянном давлении выражается формулой 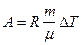 .
.
Подставив числовые значения величин, получим
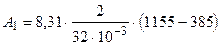 Дж = 0, 400× 106 Дж.
Дж = 0, 400× 106 Дж.
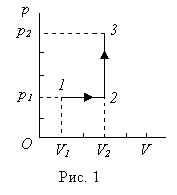
Работа газа, нагреваемого при постоянном объеме, равна нулю, т.е. А 2=0. Следовательно, полная работа, совершенная газом, равна
А=А 1+ А 2=0, 4× 106 Дж.
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии D U и работы А: Q = D U+A, следовательно,
Q =0, 4× 106 Дж+3, 24× 106 Дж=3, 64× 106 Дж=3, 64 МДж.
График процесса приведен на рис.1.
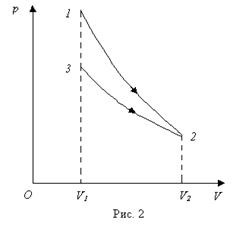
Пример 6. В цилиндре под поршнем находится водород массой m =0, 02 кг при температуре T =300 К. Водород сначала расширился адиабатически, увеличив свой объем в n 1=5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n 2=5 раз. Найти температуру в конце адиабатического расширения и работу, совершенную газом при этих процессах. Изобразить процесс графически.
Решение. Температуры и объемы газа, совершающего адиабатический процесс, связаны между собой соотношением
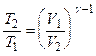 , или
, или 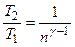 ,
,
где g-отношение теплоемкости газа при постоянном давлении и постоянном объеме (для водорода как двухатомного газа g=1, 4):
n 1 = V 2/ V 1 = 5.
Отсюда получаем следующее выражение для конечной температуры Т 2:
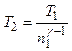 .
.
Подставляя числовые значения заданных величин, находим
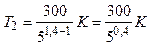 .
.
Так как 50, 4=1, 91 (находится логарифмированием), то
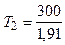 К= 157 К.
К= 157 К.
Работа А 1 газа при адиабатическом расширении может быть определена по формуле
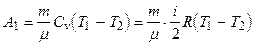 ,
,
где Cv - молярная теплоемкость газа при постоянном объеме.
Подставив числовые значения величин: R =8, 31 Дж/(моль× К), i =5 (для водорода как двухатомного газа), m=2× 10-3 кг/моль, m =0, 02 кг, Т 1=300 К, Т 2=157 К в правую часть последней формулы и выполняя арифметические действия, получим
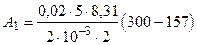 Дж=2, 98× 104 Дж.
Дж=2, 98× 104 Дж.
Работа А 2 газа при изотермическом процессе может быть выражена в виде
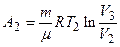 , или
, или 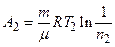 ,
,
где n 2= V 2/ V 3=5.
Подставляя известные числовые значения величин, входящих в правую часть этого равенства, и выполняя арифметические действия, находим
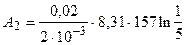 Дж= = -2, 10× 104 Дж.
Дж= = -2, 10× 104 Дж.
Знак “минус” показывает, что работа совершается над газом внешними силами. График процесса приведен на рис.2
Пример 7. Тепловая машина работает по обратимому циклу Карно. Температура нагревателя Т 1=500 К. Определить термический к.п.д. h цикла и температуру Т 2 охладителя тепловой машины, если за счет каждого килоджоуля теплоты, полученной от нагревателя, машина совершает работу А =350 Дж.
Решение. Термический к.п.д. тепловой машины, называемый также коэффициентом использования теплоты, показывает, какая доля теплоты, полученной от нагревателя, превращается в механическую работу. Термический к.п.д. выражается формулой
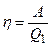 ,
,
где Q 1 - теплота, полученная от нагревателя; А - работа, совершенная рабочим телом тепловой машины.
Подставив числовые значения в эту формулу, получим
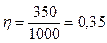 .
.
Зная к.п.д. цикла, можно по формуле 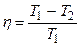 определить температуру охладителя Т2:
определить температуру охладителя Т2:
Т 2= Т 1(1- h).
Подставив в эту формулу полученное значение к.п.д. и температуры Т 1 нагревателя, получим
Т 2=500(1-0, 35) К=325 К.
Пример 8. В сосуде объемом V =30 л находится m =100 г кислорода под давлением р =3× 105 Па. Определить наиболее вероятное значение кинетической энергии молекул О2.
Решение. Вероятное значение кинетической энергии молекул соответствует максимум кривой распределения Максвелла по кинетическим энергиям
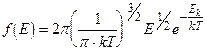 (1)
(1)
Задача сводится к нахождению экстремума функции f (E).
Определим первую производную g ’(E) и приравняем ее нулю, получим
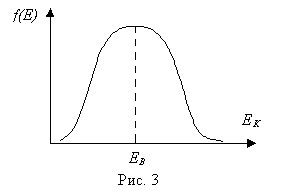
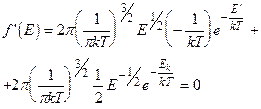 (2)
(2)
Отсюда Е в =kT/2 (3) температуру найдем из уравнения Менделеева-Клайперона
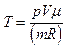 (4)
(4)
Подставим (4) в (3) и получим
 =16× 10-22Дж=
=16× 10-22Дж=
=1, 6× 10-21 Дж.
Пример 9. Определить массу воздуха в цилиндре с основанием D S =1 м2 и высотой h =1 км. Считать, что воздух находится при нормальных условиях.
Решение. Распределение Больцмана для одномерного случая имеет вид
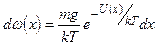
Число молекул dN в слое воздуха толщиной dx на высоте х от поверхности Земли
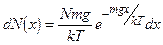
Проинтегрировав dN (x) по х в пределах от 0 до h, найдем полное число молекул в данном цилиндре
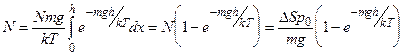
Умножив N на массу одной молекулы, получим искомую массу
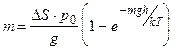 ,
,