
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекулярно-кинетическая теория
|
|
В соответствии с МКТ при хаотическом движении учитывается только поступательное и вращательное движение молекул, а остальными видами движения пренебрегают. Пространственное движение молекул раскладывается вдоль осей х, y, z. Считается, что внутренняя энергия равномерно распределяется вдоль х, у, z. В зависимости от количества атомов в молекуле число степеней свободы составляет
I ат. газ (Ar) - i = 3
II ат. газ (N 2) - i = 5
III и более ат. газ (СО 2) - i = 6
Покажем связь между с, u, R, μ R, Т. После преобразования уравнения для расчета давления по МКТ, записанного для 1 м 3.
 .
.
Легко получить, что
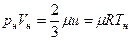 ,
,
откуда
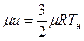 .
.
Считают, что внутренняя энергия и распределяется равномерно по осям. Тогда для (i = 1) уравнение принимает вид:
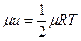 .
.
Для любого числа степеней свободы это уравнение принимает вид:
- для 1 кмоля
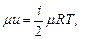 кДж /(кг · К);
кДж /(кг · К);
-для 1 кг
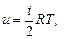 кДж /(кг · К)
кДж /(кг · К)
Установим связь между с, i и R для двух процессов: изохорного и изобарного.
Изохорный процесс:
Так как по первому закону термодинамики в изохорном процессе
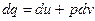 , при
, при 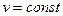 ,
, 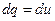 , то
, то
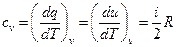 ,
, 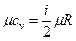 .
.
В зависимости от атомности газов μ сv составляют
I ат. газ (Ar): i = 3, 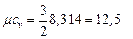 кДж /(кг · К)
кДж /(кг · К)
II ат. газ (N 2): i = 5, 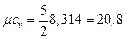 кДж /(кг · К)
кДж /(кг · К)
III ат. газ (СО 2): i = 6, 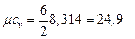 кДж /(кг · К)
кДж /(кг · К)
Тогда, например, для воздуха:
 кДж /(кг · К)
кДж /(кг · К)
Изобарный процесс:
Из уравнения Майера получим:
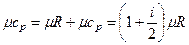 ,
,
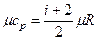 ;
; 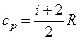 .
.
Например, для воздуха: 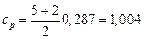 кДж /(кг · К)
кДж /(кг · К)
Тогда для разных газов будем иметь
I ат. газ (Ar): i = 3, 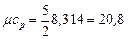 кДж /(кмоль · К)
кДж /(кмоль · К)
II ат. газ (N 2): i = 5, 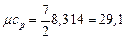 кДж /(кмоль · К)
кДж /(кмоль · К)
III ат. газ (CO 2) i = 6,  кДж /(кмоль · К)
кДж /(кмоль · К)
Следовательно, при одной и той же атомности газов μ cv и μ cp для разных газов - величины постоянные.
Например, для воздуха:
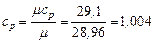 кДж /(кг · К)
кДж /(кг · К)
Теплоемкость идеальных газов зависит только от молекулярной массы, температуры и характера процесса Теплоемкость реальных газов зависит также и от давления.