Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пояснения к работе. Химические свойства спиртов
|
|
Химические свойства спиртов
1) Кислотные свойства: Спирты — амфотерные соединения, могут образовывать соли и комплексы с активными металлами. Например:
СН3 – СН2–ОН + Na —> СН3– СН2–ОNa + Н2
2) Взаимодействие с галогеноводородами:
R-OH + HHal —> RHal + H2O
HF не вступает в эту реакцию так как его кислотность недостаточна.
3) Межмолекулярная дегидратация(образование простых эфиров):
R-OH + R'-OH -> R-O-R' + H2O
Катализатором данной реакции служит кислота. Чаще всего используют серную кислоту. Легче всего реагируют третичные спирты.
4) Внутримолекулярная дегидратация:
C2H5OH —> CH2=CH2 + H2O
Спирты дегидратируются по правилу Зайцева. Легче всего отщепляют воду третичные спирты. Межмолекулярная и внутримолекулярная дегидратация являются конкурирующими реакциями. Но вторая протекает при более высокой температуре.
5) Реакция этерификации. Спирты реагируют с кислотами, при этом образуются сложные эфиры.
а)R—ОН + HNO3 —> R—О—NO2 + Н2О
б)R'-OH + R-COOH —> R-C(O)-OR' + H2O
Реакция является обратимой. Также при взаимодействии с неорганическими кислотами-окислителями(например с азотной) протекает побочная реакция - окисление.
6) Окисление спиртов Спирты окисляются легче, чем углеводороды. Первичные и вторичные спирты окисляются легче третичных. Первичные окисляются до альдегидов, вторичные — до кетонов. В случае первичных спиртов может протекать дальнейшее окисление образующихся альдегидов до соответствующих карбоновых кислот.
7) R-OH —> R-CHO —> R-COOH
Химические свойства альдегидов
1) Альдегиды медленно окисляются кислородом воздуха в карбоновые кислоты:
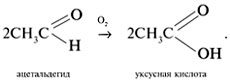
2) Качественная реакция на альдегиды – реакция «серебряного зеркала». Реакция состоит во взаимодействии альдегида RСНО с водно-аммиачным раствором оксида серебра(I), представляющим растворимое комплексное соединение [Ag(NН3)2]OH. Реакцию проводят при температуре, близкой к температуре кипения воды (80–100 °С). В результате на стенках стеклянного сосуда (пробирки, колбы) образуется осадок металлического серебра – «cеребряное зеркало»:
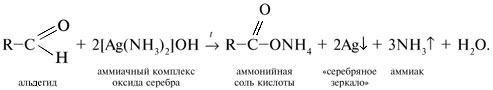
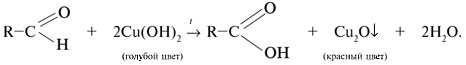
3) Восстановление гидроксида меди(II) в оксид меди(I) – другая характерная реакция альдегидов. Реакция протекает при кипячении смеси и состоит в окислении альдегида. Точнее сказать, происходит внедрение атома [О] окислителя Cu(OH)2 по связи С–Н альдегидной группы. При этом изменяются степени окисления карбонильного углерода (от +1 до +3) и атома меди (от +2 до +1). При нагревании голубого осадка Cu(OH)2 в смеси с альдегидом наблюдается исчезновение голубой окраски и образование красного осадка Cu2O:
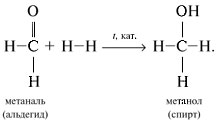
4) Альдегиды присоединяют водород Н2 по двойной связи С=О при нагревании в присутствии катализатора (Ni, Pt, Pd). Реакция сопровождается разрывом  -связи в карбонильной группе С=О и присоединением по месту ее разрыва двух атомов Н молекулы водорода Н–Н. Таким образом из альдегидов получают спирты:
-связи в карбонильной группе С=О и присоединением по месту ее разрыва двух атомов Н молекулы водорода Н–Н. Таким образом из альдегидов получают спирты: